что такое двухфазный инсулин
Инсулин двухфазный [человеческий генно-инженерный]
Фармакологическое действие
Гипогликемический препарат средней продолжительности действия, получен методом рекомбинантной ДНК-технологии. Является комбинацией инсулинов короткой и средней продолжительности действия в соотношении 30:70.
Взаимодействует со специфическим рецептором внешней мембраны клеток и образует инсулинрецепторный комплекс. Активируя биосинтез цАМФ в жировых клетках и клетках печени или непосредственно проникая в мышечные клетки, исулинрецепторный комплекс стимулирует внутриклеточные процессы, в том числе синтез ряда ключевых ферментов (гексокиназы, пируваткиназы, гликогенсинтетазы и др.). Снижение концентрации глюкозы в крови обусловлено повышением её внутриклеточного транспорта, в том числе усилением поглощения и усвоения тканями, стимуляцией гликогенеза, гликогеногенеза, синтеза белка, снижением продукции глюкозы печенью и др.
Продолжительность действия инсулина в основном обусловлена скоростью всасывания, которая в свою очередь зависит от нескольких факторов (в том числе от дозы, способа и места введения). Начало действия после подкожного введения — через 30 минут, максимальный эффект развивается через 2–8 часов, продолжительность действия — до 24 часов. Часто назначают в комбинации с препаратами инсулина короткого действия.
Фармакокинетика
Всасывание зависит от способа введения (подкожно, внутримышечно), места введения (живот, бедро, ягодицы), объёма инъекции, концентрации инсулина и др. Распределяется в тканях неравномерно. Не проникает через плацентарный барьер и в грудное молоко. Период полувыведения — несколько минут. Разрушается инсулиназой, в основном в печени и почках. Выводится почками (30–80 %).
ИНСУЛИН-ИЗОФАН ДВУХФАЗНЫЙ ДЛЯ ИНЪЕКЦИЙ (BIPHASIC ISOPHANE INSULIN INJECTION) ОПИСАНИЕ
Фармакологическое действие
Показания активного вещества ИНСУЛИН-ИЗОФАН ДВУХФАЗНЫЙ ДЛЯ ИНЪЕКЦИЙ
Сахарный диабет типа 1 (инсулинзависимый).
Сахарный диабет типа 2 (инсулиннезависимый), в т.ч. при полной или частичной резистентности к пероральным гипогликемическим средствам (комбинированная терапия); при интеркуррентных заболеваниях, оперативных вмешательствах; при беременности (при неэффективности диетотерапии).
Режим дозирования
Побочное действие
Побочные эффекты, связанные с влиянием на углеводный обмен: гипогликемические состояния (бледность, усиление потоотделения, ощущение сердцебиения, расстройства сна, тремор).
Противопоказания к применению
Применение при беременности и кормлении грудью
При беременности и в период лактации потребность в инсулине изменяется, что следует учитывать для поддержания адекватного контроля обмена веществ.
Инсулин не проникает через плацентарный барьер.
Особые указания
Переход с одного вида инсулина на другой следует проводить под контролем уровня глюкозы в крови.
При передозировке инсулина, если больной в сознании, необходимо ввести глюкозу перорально; при потере сознания вводят глюкозу в/в или глюкагон п/к, в/м или в/в.
Влияние на способность к управлению транспортными средствами и механизмами
При переводе пациента на данный инсулин возможно временное снижение скорости психомоторных реакций.
При первичном применении инсулина, смене его вида или при наличии значительных физических или психических стрессов возможно снижение скорости психомоторных реакций и способности к концентрации внимания.
Лекарственное взаимодействие
Гипогликемический эффект инсулина усиливают ингибиторы МАО, неселективные бета-адреноблокаторы, сульфаниламиды, анаболические стероиды, тетрациклины, клофибрат, циклофосфамид, фенфлурамин; препараты, содержащие этанол.
Гипогликемический эффект инсулина понижают пероральные контрацептивы, глюкокортикоиды, тиреоидные гормоны, тиазидные диуретики, гепарин, препараты лития, трициклические антидепрессанты.
Под влиянием резерпина и салицилатов возможно как ослабление, так и усиление действия инсулина.
Бета-адреноблокаторы, клофелин, резерпин могут маскировать проявление симптомов гипогликемии.
Этанол, различные дезинфицирующие средства могут снижать биологическую активность инсулина.
При применении препаратов инсулина в комбинации с препаратами группы тиазолидиндиона у пациентов с сахарным диабетом 2 типа может возникать задержка жидкости в организме, в результате чего повышается риск развития и прогрессирования хронической сердечной недостаточности, особенно у пациентов с заболеваниями сердечно-сосудистой системы и наличием факторов риска хронической сердечной недостаточности. Пациентов, получающих такую терапию, следует регулярно обследовать с целью выявления признаков сердечной недостаточности. При возникновении сердечной недостаточности терапию следует осуществлять в соответствии с текущими стандартами лечения.
Применение двухфазного инсулина аспарта в лечении больных сахарным диабетом 2 типа
Сахарный диабет (СД) 2 типа является одним из наиболее распространенных хронических заболеваний и носит характер неинфекционной эпидемии. В настоящее время около 200 млн человек в мире страдают этим недугом. Количество
Сахарный диабет (СД) 2 типа является одним из наиболее распространенных хронических заболеваний и носит характер неинфекционной эпидемии. В настоящее время около 200 млн человек в мире страдают этим недугом. Количество болеющих СД ежегодно увеличивается на 5–7% и каждые 15 лет удваивается. СД характеризуется ранней инвалидизацией и высокой смертностью больных вследствие поздних сосудистых осложнений. Это обстоятельство ставит данное заболевание в ряд социально значимых. Среди пациентов с этой патологией больные СД 2 типа составляют более 90%.
В основе патофизиологических нарушений при СД 2 типа лежат два основных дефекта — инсулинорезистентность и дисфункция β-клеток поджелудочной железы (нарушение секреции инсулина и относительный дефицит инсулина). Эти два нарушения очень тесно взаимосвязаны и сначала приводят к повышению уровня глюкозы в крови после еды (постпрандиальная гликемия — ППГ), а в дальнейшем и к гипергликемии натощак. Кроме того, уменьшается чувствительность периферических тканей к инсулину.
Международная диабетическая федерация (IDF) разработала рекомендации, регламентирующие терапевтические цели при СД 2 типа (табл.), исходя из которых можно ставить индивидуальные задачи по улучшению компенсации заболевания.
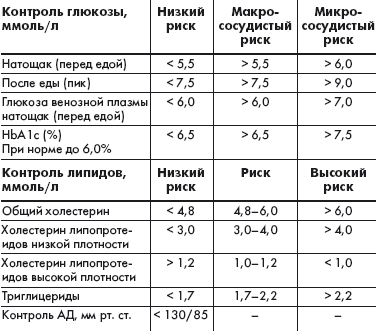 |
| Таблица. Терапевтические цели при сахарном диабете 2 типа |
Строгий контроль гликемии имеет первостепенное значение для снижения риска возникновения микро- и макрососудистых осложнений при СД 2 типа. Тем не менее, как показывают результаты Британского проспективного исследования сахарного диабета (UKPDS), по мере прогрессирования СД 2 типа становится все труднее поддерживать оптимальный уровень глюкозы крови натощак (ГКН) и гликированного гемоглобина (HbA1c) с помощью только гипокалорийной диеты, физических нагрузок. В этом случае назначаются пероральные сахароснижающие препараты (ПССП). Главная цель в лечении СД 2 типа — поддержание максимально приближенного к норме уровня сахара крови (гликемии).
В настоящее время в лечении СД 2 типа используются следующие группы ПССП.
Препараты, усиливающие секрецию инсулина поджелудочной железой. К этой группе ПССП относятся производные сульфонилмочевины (ПСМ) — глибенкламид (Манинил), гликлазид (Диабетон МВ), глимепирид (Амарил, Глемаз), гликвидон (Глюренорм) и прандиальные регуляторы гликемии (глиниды) — репаглинид (НовоНорм®). У каждого из перечисленных препаратов есть свои особенности, касающиеся в основном продолжительности действия. За счет усиления стимуляции инсулина поджелудочной железой эти препараты снижают уровень глюкозы в крови.
Препараты, улучшающие чувствительность к инсулину. Эта группа препаратов включает бигуаниды и инсулиновые сенситайзеры (тиазолидиндионы). Основным представителем группы бигуанидов является метформин (Глюкофаж, Сиофор, Багомет, Метфогамма). Метформин снижает продукцию глюкозы печенью за счет торможения глюконеогенеза, усиливает усвоение глюкозы периферическими тканями без стимуляции секреции инсулина поджелудочной железой. Метформин является препаратом выбора в лечении пациентов с СД 2 типа и избыточной массой тела. Препарат успешно применяется в комбинации с другими ПССП и инсулином.
Подгруппа инсулиновых сенситайзеров (тиазолидиндионов) представлена пиоглитазоном (Актос) и росиглитазоном (Авандия).
Препараты, уменьшающие всасывание углеводов в кишечнике. К этой группе относится акарбоза (Глюкобай), являющаяся ингибитором α-глюкозидаз. Акарбоза препятствует подъему уровня глюкозы в крови после еды за счет торможения всасывания углеводов, поступающих с пищей, в тонком кишечнике.
Комбинированные препараты. Они состоят из нескольких компонентов, к ним относятся, например, Глибомет (глибенкламид + метформин), Авандамет (росиглитазон + метформин).
Однако эффективное действие многих ПССП проявляется только при сохранении остаточной секреции β-клеток. Прогрессирующее снижение функции β-клеток и инсулинорезистентность, характерные для СД 2 типа, препятствуют достижению желаемого эффекта даже при комбинированной терапии несколькими ПССП. В этом случае наилучшим из имеющихся в арсенале вариантов лечения является инсулинотерапия. Один из выводов исследования UKPDS гласит: «Мы не начинаем инсулинотерапию так рано и так агрессивно, как это необходимо» [2].
Поддержание уровня гликированного гемоглобина в пределах рекомендованных целевых значений ( Рисунок 1. Суточные профили гликемии в 1-й и 2-й группах пациентов исходно и через 3,5 мес на фоне терапии препаратом НовоМикс 30
В исследовании ACTION (Achieving Control Through Insulin plus Oral agents) сравнивалась интенсификация терапии ПССП с инсулинотерапией в режиме двух инъекций [32]. Исследование продолжалось 24 нед. В него были включены пациенты с СД 2 типа, которым не удалось достичь целевых значений HbA1c на фоне терапии ПССП.
К завершению исследования 76% пациентов смогли достичь показателя HbA1c 7,5%. Длительность исследования составляла 6 мес. Исходно пациенты получали либо только метформин (2500 мг/сут), или только глимепирид (8 мг/сут), или комбинацию указанных препаратов (2500 мг/сут + 8 мг/сут).
В ходе исследования пациенты продолжали получать прежнюю терапию ПССП с добавлением препарата НовоМикс® 30 (n = 38). 8 пациентов были переведены на терапию плацебо + НовоМикс® 30 с отменой ПССП. Исходно масса тела и уровень HbA1c достоверно не отличались между группами.
Через 6 мес у пациентов всех групп отмечалось значительное снижение HbA1c, включая пациентов, получавших НовоМикс® 30 + плацебо. Цели контроля (HbA1c 32 кг/м2) плюс инсулин НовоРапид® прандиально. Дозы подбирались индивидуально в соотношении 3 : 2 : 1 (в завтрак, обед и ужин соответственно). ПССП отменялись в обеих группах терапии.
Оба режима терапии инсулиновыми аналогами обеспечили возможность безопасного достижения целевого уровня HbA1c 7,0%: 50% в группе терапии инсулином НовоМикс® 30 и 60% в группе терапии инсулинами Левемир® и НовоРапид® у пациентов СД 2 типа. Пациенты, ранее не получавшие инсулинотерапии, достигли равного гликемического контроля на фоне терапии двухфазным аналогом и базис-болюсной терапии.
Среднее значение ГКН также оказалось одинаковым: 8,05 ммоль/л на фоне терапии инсулином НовоМикс® 30 и 8,27 ммоль/л на фоне базис-болюсной терапии инсулинами Левемир® и НовоРапид® (р = 0,345). Частота гипогликемий была низкой и сравнимой для обоих режимов терапии инсулиновыми аналогами.
Целью рандомизированного, открытого, с параллельными группами исследования EuroMix [24] являлось сравнение эффективности безопасности двух режимов терапии инсулиновыми аналогами у 255 пациентов с СД 2 типа: инсулин НовоМикс® 30 в режиме двух инъекций в комбинации с метформином (n = 128) и инсулин Лантус в режиме одной инъекции в комбинации с глимепиридом 1 раз в сутки (n = 127). Первичным параметром исследования была разница в динамике снижения HbA1c между группами через 26 нед терапии.
 |
| Рисунок 2. Динамика прандиального прироста гликемии исходно и через 3,5 мес на фоне терапии препаратом НовоМикс 30 |
Исследование показало, что старт инсулинотерапии с использования двухфазного аналога НовоМикс® 30 в двухкратном режиме в комбинации с метформином обеспечивает более выраженное снижение уровня HbA1c и среднего прандиального прироста гликемии у больных СД 2 типа в сравнении с терапией аналогом инсулина Лантус® в режиме одной инъекции в сочетании с глимепиридом.
Нами было проведено исследование в 10 административных округах Москвы с целью изучения эффективности препарата НовоМикс® 30 в условиях повседневной клинической практики в течение 3,5 мес у 3 000 больных СД 2 типа с неудовлетворительным уровнем гликемии на фоне предшествующей терапии.
Для окончательного анализа методом случайной выборки было отобрано 309 анкет (каждая 10-я анкета). Длительность СД 2 типа составляла 11,5 ± 1,5 лет. До перевода на НовоМикс® 30 пациенты получали монотерапию ПССП или комбинированную терапию ПССП с инсулином. Уровень HbA1c в общей группе пациентов исходно составил 9,3 ± 1,5%. В ходе исследования пациенты были разделены на две группы: в 1-й группе больные получали НовоМикс® 30 в двух инъекциях в комбинации с ПССП, во 2-й — НовоМикс® 30 в трех инъекциях без ПССП.
 |
| Рисунок 3. Динамика прандиального прироста гликемии исходно и через 3,5 мес на фоне терапии препаратом НовоМикс® 30 |
1-я группа насчитывала 250 пациентов (195 женщин/55 мужчин), средняя длительность заболевания — 11,5 ± 6,2 года, исходный уровень HbA1c 9,3 ± 1,8%, ГКН 9,9 ± 2,3 ммоль/л, ППГ 11,7 ± 2,7 ммоль/л. Эта группа получала НовоМикс® 30 в двух инъекциях перед завтраком и перед ужином в комбинации с ПССП, представленными препаратами сульфонилмочевины и метформина в максимальных дозах.
Во 2-ю группу были включены 59 пациентов (44 женщины/15 мужчин), со средней длительностью заболевания 11,7 ± 7,8 года, исходными уровнями HbA1c 9,4 ± 1,8%, ГКН 9,5 ± 2,5 ммоль/л, ППГ 11,3 ± 2,6 ммоль/л. Эта группа пациентов получала НовоМикс® 30 в режиме трех инъекций перед основными приемами пищи.
Данные анализа показали, что в ходе наблюдения в обеих группах достоверно улучшились показатели суточного гликемического профиля (8 точек), определявшиеся в процессе самоконтроля (р Рисунок 4. Динамика HbA1c исходно и через 3,5 мес на фоне терапии препаратом НовоМикс® 30
К концу исследования в обеих группах пациентов уровень HbA1c снизился до 7,5 ± 0,8% (рис. 4).
Таким образом, данные по применению двухфазного аналога инсулина НовоМикс® 30 в практике лечения больных СД 2 типа позволяют сделать следующие выводы.
Литература
М. Б. Анциферов, доктор медицинских наук, профессор
Л. Г. Дорофеева
Эндокринологический диспансер Департамента здравоохранения г. Москвы
Современные препараты инсулина
Поделиться:
Как это работает?
Инсулин — гормон, который вырабатывают бета-клетки поджелудочной железы. Он необходим клеткам организма, чтобы они могли вывести глюкозу из крови и использовать ее для собственных «нужд».
При сахарном диабете 1-го типа поджелудочная железа не может вырабатывать достаточное количество инсулина, и единственная возможность компенсировать опасный дефицит — введение гормона извне в составе инсулинотерапии. При диабете 2-го типа инсулин вырабатывается в достаточном количестве, но клетки организма не реагируют на него нормально — снижается чувствительность тканей к инсулину. Чтобы ее повысить, вводят пероральные гипогликемические препараты, однако в некоторых случаях, например когда невозможно добиться компенсации диабета с помощью одних таблеток, все же назначают инсулин.
Читайте также:
Метформин при диабете
Эндогенный (т. е. поступивший в организм в составе препаратов) инсулин работает так же, как и собственный гормон, увеличивая поглощение глюкозы клетками и уменьшая ее концентрацию в крови. Таким образом препараты инсулина нормализуют углеводный обмен, предотвращают или уменьшают осложнения диабета, такие как поражение сосудов, сердца, глаз, почек и нервов.
Какими бывают препараты инсулина?
Инсулины классифицируются по двум параметрам — способу получения и длительности действия. В соответствии с первой классификацией выделяют инсулины, полученные из поджелудочных желез животных, а также человеческие инсулины, синтезированные способами генной инженерии. Последние считаются препаратами выбора, поскольку лучше переносятся организмом.
Основной критерий, по которому разделяют препараты инсулина, — длительность действия. В зависимости от нее выделяют пять основных групп (см. табл.).
Инсулины
короткого
действия
Инсулины
ультракороткого действия
Инсулин лизпро
Инсулин аспарт
Инсулин глулизин
Инсулины
комбинированного действия
(двухфазные)
Инсулин двухфазный человеческий
полусинтетический
Инсулин двухфазный человеческий
генно-инженерный
Инсулин аспарт двухфазный
Инсулины средней
длительности действия
Инсулин-изофан
Инсулин-цинк суспензия
Инсулины
длительного действия
Инсулин гларгин
Инсулин детемир
Инсулины
пролонгированного
действия
Препараты средней продолжительности действия и длительного действия
За одну единицу действия (или международную единицу) инсулина принимают активность 0,04082 мг кристаллического гормона. Для сравнения — наша поджелудочная железа в норме содержит до 8 мг инсулина, что составляет около 200 ЕД.
Как подбирают инсулин?
Как правило, больному диабетом назначают несколько препаратов инсулина различной длительности действия. Схему лечения подбирают индивидуально, основываясь на состоянии углеводного обмена и ответе конкретного пациента. Чаще всего препараты инсулина применяют в трех разных режимах:
Как вводят инсулин?
Препараты инсулина обычно вводят подкожно, хотя допускается и внутримышечное введение. Инсулины короткого действия в форме растворов (не суспензий!) при диабетической прекоме и коме вводят внутривенно.
Быстрее всего инсулин проникает в кровь при введении в подкожную клетчатку передней брюшной стенки, медленнее из области плеча и передней поверхности бедра. Хуже всего всасывается инсулин, введенный в подлопаточную область или ягодицу.
Современные препараты инсулина выпускаются в форме одноразовых шприц-ручек, позволяющих легко и быстро вводить препарат подкожно. Иногда используются инсулиновые помпы, которые прикрепляются к пациенту и постоянно подают инсулин в кровь через иглу в определенной дозировке, однако такие приспособления для среднестатистического больного пока в диковинку, и самым привычным способом введения остается подкожная инъекция инсулина.
Напоследок отметим, что прогресс не стоит на месте, и сегодня ученые вплотную подобрались к созданию самой удобной формы инсулина — пероральной, в виде таблеток. Но пока работы еще не завершены, и больные диабетом продолжают использовать привычный инсулин в форме инъекционного раствора для подкожного введения.
Что такое двухфазный инсулин
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Москва
Двухфазные инсулиновые аналоги: на что они способны при терапии пациентов с сахарным диабетом 2-го типа
Журнал: Проблемы эндокринологии. 2011;57(4): 48-55
Оранская А. Н. Двухфазные инсулиновые аналоги: на что они способны при терапии пациентов с сахарным диабетом 2-го типа. Проблемы эндокринологии. 2011;57(4):48-55.
Oranskaya A N. Biphasic insulin analogs: their potential in the management of type 2 diabetes mellitus. Problemy Endokrinologii. 2011;57(4):48-55.
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Москва
ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России, Москва
«Инсулиновая эра» началась чуть меньше ста лет назад, когда в августе 1921 г. появилось сообщение об открытии румынского ученого Н. Паулеску. Он был первым, кто получил водный экстракт из поджелудочной железы собак и крупного рогатого скота, при введении которого в кровь животным отмечалось снижение гликемии, глюкозурии, вплоть до развития гипогликемии. Первое применение инсулина для снижения гликемии у человека — 1922 г. Был применен экстракт из поджелудочных желез крупного рогатого скота, полученный Ч. Бестом и Ф. Бантингом и приготовленный по особой технологии, разработанной Дж. Коллипом. Начиная с этого периода времени в терапии сахарного диабета (СД) применяли естественные препараты инсулинов. В 1936 г. в лабораториях компании «Ново Нордиск» (Дания) проф. Х.С. Хагедорном впервые в мире был создан нейтральный инсулин средней продолжительности действия. «Нейтральный инсулин Хагедорна» стал прототипом протафана. «Первые» препараты инсулина позволяли продлить жизнь пациентов, страдающих СД, но имели достаточно много побочных эффектов, не могли поддерживать нормальный уровень гликемии на протяжении целых суток. В 1946 г. разработан первый нейтральный инсулин продленного действия изофан-инсулин (NPH), но и его продолжительность действия была недостаточной. Исследования продолжались, и в 1951 г. появились разработки по пролонгации действия инсулина при помощи цинка. Так, с 1953 г. начато применение суспензии цинк-инсулина продленного действия. Однако это все равно были инсулины на «чужеродном» белке, что увеличивало количество и частоту побочных явлений. В 1953 г. Сангером была расшифрована химическая структура инсулина, это позволило улучшить качество применяемых препаратов инсулина. Началось время активного научного поиска для решения проблемы высокой очистки гормона. Высокоэффективная хроматография позволила получать монокомпонентные инсулины, практически лишенные дополнительных примесей. Данная технология позволила избавиться от многих побочных реакций при инсулинотерапии, отсрочить развитие поздних осложнений СД и установить новые стандарты степени очистки инсулина. Но, по-настоящему, эра фармакологической «гонки» за лучший препарат инсулина началась только в 1977 г. с открытия структуры ДНК и внедрения рекомбинантных технологий. Это позволило определить индивидуальные последовательности аминокислот в белках, изменять их и оценивать биологические эффекты полученных продуктов, что в свою очередь привело к возникновению в фармакологии нового направления по синтезу новых молекул с улучшением свойств ранее изученных веществ, лекарственных препаратов. В 1981 г. впервые в мире был получен рекомбинантный человеческий инсулин. Так закончилась эра инсулинов животного происхождения, для коррекции гликемии стали применять генно-инженерные инсулины, абсолютно идентичные тому, который вырабатывается поджелудочной железой человека. В компании «Ново Нордиск» получают их путем сложной биотехнологической «перестройки» ДНК обычных пекарских дрожжей — продукта, применяемого человечеством на протяжении тысячелетий. Со временем оказалось, что, несмотря на «абсолютную идентичность», человеческие генно-инженерные инсулины отличались от собственного инсулина по фармакодинамике и фармакокинетике. Пролонгированные инсулины имеют пики действия, что увеличивает риск развития гипогликемических состояний. Короткие инсулины имеют максимальную активность действия, не позволяющую иметь стойкую постпрандиальную нормогликемию, да и начало действия достаточно отсрочено от момента введения препарата, что неудобно пациентам. Работа над улучшением свойств инсулинов была продолжена. И в 1999 г. появился первый инсулиновый аналог короткого действия компании «Ново Нордиск» – НовоРапид, а чуть позже и пролонгированный инсулин Детемир. В сравнении с человеческими инсулинами длительного действия (НПХ) аналоги инсулина продленного действия обладают более продолжительным действием, у них отсутствует пик действия и как следствие снижется риск гипогликемий. К особым преимуществам пролонгированного инсулина Детемир относятся низкая интраиндивидуальная вариабельность и меньшее увеличение массы тела, при равном и даже превосходящем НПХ сахарснижающем эффекте. Таким образом, начиная с прошлого столетия, фармакологический рынок препаратов инсулина значительно изменился — от бычьих-свиных через человеческие генно-инженерные, к аналоговым инсулинам. Препараты инсулина, применяемые в настоящее время, различаются в основном по четырем основным признакам: по происхождению; по скорости наступления эффектов и его продолжительности; по способу очистки и степени чистоты препаратов, а также концентрации и процентному соотношению инсулина. Не так давно, в практику врачей вошли микст-инсулины, т.е. комбинированные в одном растворе и инсулин короткого действия, и пролонгированная форма инсулина. Эта статья будет посвящена применению именно таких аналогов инсулина.
СД относится к хроническим заболеваниям с неуклонным прогрессивным ростом. Ежегодно увеличивается число пациентов как с СД 1-го типа, так и с СД 2-го типа. СД недаром называют «эпидемией и пандемией». Предполагается, что к 2030 г. общее число больных СД увеличится до 438 млн человек, т.е. им будет страдать каждый 19-й человек на планете. Численность больных СД в Российской Федерации составляет около 9 млн; только за последние 10 лет она возросла в 2 раза [1]. По данным Минздравсоцразвития России, в 2000 г. СД страдали 162 тыс. человек, а в 2009 г. этот показатель увеличился до 308,6 тыс. человек [заболеваемость населения социальнозначимыми болезнями (зарегистрированы больные с диагнозом, установленным впервые в жизни) данные Минздравсоцразвития России, расчет Росстата]. По прогнозам ВОЗ, к 2030 г. в России будет 13,8 млн больных СД. Тяжесть заболевания формируют его осложнения, они же приводят к гибели пациентов. По статистическим данным, каждые 6—7 пациентов из 10 погибают от макроангиопатических осложнений диабета. Причем наряду с распространенностью СД нарастают и социально-экономические потери, связанные с развитием тяжелых инвалидизирующих осложнений. Отмечено, что через 20 лет после установления диагноза СД приблизительно у 2 /3 больных развивается ретинопатия, а у 30% в течение оставшейся жизни — нефропатия [2, 3]. Во всем мире признано, что нормализация уровня гликемии способствует снижению скорости развития и тяжести диабетических осложнений.
Представительные исследования (UKPDS, Steno-2, DCCT/EDIC) доказывают, что нормализация уровня гликемии при СД снижает риск развития микро- и макрососудистых осложнений [4—6]. В связи с этим национальные и международные организации установили целевые уровни гликемии, достижение которых является первостепенной задачей пациентов и врачей. Для снижения риска микрососудистых и макрососудистых осложнений целевой уровень HbA1c несколько отличается в разных странах (ADA/EASD, 2009), но он не должен превышать 7% [7, 8].
Патогномоничным лечением СД 1-го типа является постоянная заместительная инсулинотерапия, так как ведущим механизмом развития СД 1-го типа является аутоиммунное поражение β-клеток с последующей их деструкцией и развитием абсолютного дефицита инсулина. Создание аналоговых инсулинов с максимально приближенными к физиологическим потребностям человека свойствами значительно улучшило качество жизни наших пациентов.
В настоящее время рассматривают две основные теории патогенеза формирования СД 2-го типа: снижение чувствительности периферических инсулинзависимых тканей к действию инсулина или инсулинорезистентность (ИР) и недостаточная (неадекватная) секреция инсулина. В последние годы доказано, что ИР является генетически детерминированным процессом, который усугубляется по мере прогрессирования ожирения. Именно поэтому большое внимание уделяется контролю массы тела на фоне проведения инсулинотерапии, ведь инсулин — основной гормон, способствующий увеличению жировой массы. Неспособность инсулярного аппарата поджелудочной железы к адекватной продукции инсулина для преодоления ИР развивается постепенно. По данным лабораторных исследований у пациентов формируется сначала недостаточность, а позже отсутствие 1-й фазы секреции инсулина, физиологическая роль которой состоит в регуляции посталиментарной гипергликемии. Формируется так называемый «порочный круг»: снижение чувствительности периферических тканей к инсулину, с одной стороны, стимулирует его секрецию, а с другой — за счет нарастания постпрандиальной гипергликемии появляется феномен «глюкозотоксичности», приводящий к снижению секреторных возможностей β-клеток. При манифестации СД 2-го типа в среднем секреция инсулина снижается на 50%, продолжая снижаться на 4—6% в год [9], а через 10 лет от момента дебюта СД 2-го типа у 50—60% пациентов снижается инсулинсекреторная функция β-клеток поджелудочной железы более чем на 75% от нормальных значений, что приводит к необходимости проведения заместительной терапии инсулином [6, 10]. Гиперинсулинизм, направленный на преодоление гипергликемии, приводит к повышению аппетита, следовательно, к нарастанию массы тела, что усугубляет ИР и повышает потребность в секреции инсулина. Короткие курсы инсулинотерапии показаны пациентам с СД 2-го типа, имеющим нормальную массу тела, с учетом положительного влияния данной терапии на функциональное состояние островкового аппарата поджелудочной железы. В последнее время все чаще для достижения компенсации углеводного обмена, уменьшения осложнений СД в лечении пациентов с СД 2-го типа применяют инсулинотерапию. Данный вид терапии при СД 2-го типа в США составляет приблизительно 40%, в России 5 лет назад составлял только 10%, в настоящее время уже более 20% пациентов РФ с СД 2-го типа находятся на инсулинотерапии.
Когда же необходимо назначать инсулинотерапию пациентам с СД 2-го типа? Ответ на этот вопрос дает один из выводов исследования UKPDS, который гласит: «Мы не начинаем инсулинотерапию так рано и так агрессивно, как это необходимо» [10]. Боязнь начала инсулинотерапии из-за возможного развития гипогликемических состояний, прироста веса и т.д. приводит к формированию тяжелых осложнений у достаточно молодых людей трудоспособного возраста. Применение инсулинотерапии позволяет адекватно контролировать не только гликемию натощак (ГКН), но и постпрандиальный уровень гликемии (ППГ). Именно ППГ приводит к повышению риска формирования сердечно-сосудистых осложнений [11] и вносит существенный вклад в повышенный уровень НbА1с [12, 13]. Использование двухфазных аналогов инсулина позволяет добиться улучшения контроля ППГ с одновременным поддержанием ГКН в пределах рекомендуемых значений у пациентов с СД 2-го типа при невозможности достичь нормогликемии на фоне терапии ПССП.
Рассмотрим отличительные особенности современного двухфазного аналогового инсулина НовоМикс 30. Необходимо отметить, что аспарт, главный компонент данного инсулина, имеет in vitro доказанные данные о безопасности, идентичные данным по безопасности для человеческого инсулина [14, 15]. НовоМикс 30 представляет собой суспензию из 30% растворимого инсулина аспарт и 70% протаминкристаллизованного инсулина аспарт. Фармакокинетические свойства аналога инсулина аспарт обеспечивают активное всасывание растворимого компонента, быстрое начало его действия и быстрое выведение из организма [16]. Именно эти особенности НовоМикс 30 способствуют оптимальному контролю ППГ у пациентов СД 2-го типа. При этом более медленное всасывание протаминированной составляющей обеспечивает базальный компонент инсулинотерапии и имеет такой же профиль абсорбции, как НПХ-инсулин [17] (рис. 1). 
Оптимизированная современная инсулинотерапия предполагает соответствие уровня инсулина в плазме колеблющимся в зависимости от приема пищи показателям глюкозы в крови. После приема пищи, при повышении уровня гликемии, необходим соответствующий пик инсулинемии. В этой ситуации быстрый компонент инсулина НовоМикс 30 — аспарт позволяет добиться соответствия пиков постпрандиальной гликемии и инсулинемии, что дает возможность улучшить контроль ППГ в сравнении с человеческим инсулином короткого действия. Быстрая элиминация действия инсулина аспарт по сравнению с отсроченной по времени элиминацией ЧИ позволяет минимизировать риск поздней постпрандиальной гипогликемии.
Хотя препарат и является двухфазным инсулином, профиль его действия характеризуется одним пиком, что позволяет воспроизвести профиль физиологической секреции инсулина. Сравнение фармакодинамики и фармакокинетики НовоМикс 30 и базис-болюсной терапии инсулинами гларгин и глюлизин было проведено в 2009 г. группой ученых под руководством T. Heise. В результате исследования было доказано, что двухфазный аналоговый инсулин аспарт имеет совпадающий с базис-болюсной терапией профиль [18]. Этот двухфазный инсулиновый аналог может использоваться как в виде монотерапии, так и в комбинации с ПССП.
Разработано несколько схем терапии инсулином НовоМикс 30. Он может быть использован от одного до трех раз в день [19] (рис. 2). 
J. Garber и соавт. получили следующие результаты: в режиме одной инъекции 41% пациентов достигли целей контроля по рекомендациям ADA (HbA1c
 Читайте также:
Читайте также: 

