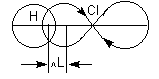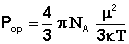что такое дипольный момент в химии
ДИПОЛЬНЫЙ МОМЕНТ
Полезное
Смотреть что такое «ДИПОЛЬНЫЙ МОМЕНТ» в других словарях:
ДИПОЛЬНЫЙ МОМЕНТ — физическая величина, характеризующая свойства диполя. Электрический дипольный момент равен произведению положительного заряда электрического диполя на расстояние между зарядами и направлен от отрицательного заряда к положительному. Магнитный… … Большой Энциклопедический словарь
Дипольный момент — Классическая электродинамика Магнитное поле соленоида Электричество · Магнетизм Электростатика Закон Кулона … Википедия
дипольный момент — физическая величина, характеризующая свойства диполя. Электрический дипольный момент равен произведению положительного заряда электрического диполя на расстояние между зарядами и направлен от отрицательного заряда к положительному. Магнитный… … Энциклопедический словарь
дипольный момент — постоянный электрический момент частицы; дипольный момент; отрасл. постоянный дипольный момент Электрический момент частицы (молекулы или комплекса молекул) при отсутствии внешнего электрического поля … Политехнический терминологический толковый словарь
дипольный момент — dipolinis momentas statusas T sritis Standartizacija ir metrologija apibrėžtis Apibrėžtį žr. priede. priedas( ai) Grafinis formatas atitikmenys: angl. dipole moment vok. Dipolmoment, n rus. дипольный момент, m pranc. moment de dipôle, m; moment… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
дипольный момент — dipolinis momentas statusas T sritis chemija apibrėžtis Vektorinis dydis, lygus bet kurio dipolio elektros krūvio ir atstumo tarp polių sandaugai. atitikmenys: angl. dipole moment rus. дипольный момент ryšiai: sinonimas – elektrinio dipolio… … Chemijos terminų aiškinamasis žodynas
дипольный момент — dipolinis momentas statusas T sritis fizika atitikmenys: angl. dipole moment vok. Dipolmoment, n rus. дипольный момент, m pranc. moment dipolaire, m … Fizikos terminų žodynas
Дипольный момент — электрический, физическая величина, характеризующая электрические свойства системы заряженных частиц. Д. м. системы из N заряженных частиц равен где ei заряд частицы номера i, а ri её радиус вектор. Д. м. нейтральной в… … Большая советская энциклопедия
ДИПОЛЬНЫЙ МОМЕНТ — физ. величина, характеризующая свойства диполя. Электрич. Д. м. равен произведению положит. заряда электрич. диполя на расстояние между зарядами и направлен от отрицат. заряда к положительному. Магн. Д. м. контура с током пропорционален… … Естествознание. Энциклопедический словарь
Метод отталкивания локализованных электронных пар валентной оболочки центрального атома (метод Гиллеспи); дипольный момент молекулы
Материалы портала onx.distant.ru
Основные положения метода
Обозначения, используемые в методе Гиллеспи
А – центральный атом;
X – лиганд, с которым центральный атом образует химическую связь, то есть даёт связывающие электронные пары;
Е – неподелённая электронная пара;
n, m – соответственно число связывающих и неподелённых электронных пар.
Алгоритм определения строения молекул по методу Гиллеспи
Для того, чтобы определить строение молекулы методом Гиллеспи, предлагается следующий порядок действий.
(n + m) = 1/2 (Nц + Nл – z ) – π (1)
Nц – число электронов центрального атома на его внешнем электронном слое,
Nл – число электронов лигандов, участвующих в образовании связей с центральным атомом,
π – число π-связей в молекуле,
z – заряд иона (в случае определения строения молекулярного аниона).
В табл. 1. обобщаются возможные варианты использования метода Гиллеспи для определения строения различных молекул.
Таблица 1. Геометрия молекул неорганических и органических веществ.
| № | Тип молекулы | Примеры | Общее число связывающих и неподелённых электронных пар | Пространственное расположение электронных пар | Число связывающих электронных пар | Геометрия молекулы |
| 1 | AX2E0 | BeCl2, CO2 | 2 | линейное | 2 | линейная |
| 2 | AX3E0 | BF3, SO3 | 3 | правильный треугольник | 3 | правильный треугольник |
| 3 | AX2E1 | SnCl2 SO2 | 3 | правильный треугольник | 2 | угловая |
| 4 | AX4E0 | CH4, CCl4 | 4 | тетраэдр | 4 | тетраэдр |
| 5 | AX3E1 | NH3, PH3 | 4 | тетраэдр | 3 | треугольная пирамида |
| 6 | AX2E2 | H2O | 4 | тетраэдр | 2 | угловая |
| 7 | AX5E0 | PCl5 | 5 | тригональная бипирамида | 5 | тригональная бипирамида |
| 8 | AX4E1 | SF4 | 5 | тригональная бипирамида | 4 | “качели” |
| 9 | AX3E2 | ClF3 | 5 | тригональная бипирамида | 3 | “Т-образная” |
| 10 | AX2E3 | XeF2 | 5 | тригональная бипирамида | 2 | линейная |
| 11 | AX6E0 | SF6 | 6 | октаэдр | 6 | октаэдр |
| 12 | AX5E1 | ICl5 | 6 | октаэдр | 5 | квадратная пирамида |
| 13 | AX4E2 | XeF4 | 6 | октаэдр | 4 | плоская |
| 14 | A + X4E0 | NH4 + | 4 | тетраэдр | 4 | тетраэдр |
| 15 | AX4 2- E0 | SO4 2- | 4 | тетраэдр | 4 | тетраэдр |
| 16 | AX3 2- E1 | SO3 2- | 4 | тетраэдр | 3 | треугольная пирамида |
| 17 | A — X6E0 | PCl6 — | 6 | октаэдр | 6 | октаэдр |
| 18 | AX’1X»2E0 | COCl2 | 3 | правильный треугольник | 3 | правильный треугольник |
Дипольный момент молекулы
Мера полярности связи – её дипольный момент (μ) – определяется произведением:
μ = ql
где q – эффективный заряд, l – длина диполя (расстояние между двумя равными по величине и противоположными по знаку зарядами +q и –q).
Дипольный момент – это векторная величина. Понятия “дипольный момент связи” и “дипольный момент молекулы” совпадают только для двухатомных молекул. Дипольный момент сложной молекулы равен векторной сумме дипольных моментов всех связей. Дипольный момент многоатомной молекулы зависит не только от полярности отдельных связей в молекуле, но и от геометрической формы молекулы.
Рис. 1. Дипольные моменты молекул СО2 и Н2О
Примеры определения строения молекул по методу Гиллеспи
Пример 1. Молекула BF3.
n + m = (4 + 2)/2 = 3
(у олова на внешнем слое четыре электрона и два электрона дают атомы хлора; π-связи в молекуле отсутствуют).
Пример 3. Молекула XeF4.
(у атома Хе восемь электронов на внешнем электронном слое и два электрона дают атомы F; π-связи в молекуле отсутствуют).
Пример 4. Молекула SO2.
(у атома серы на внешнем электронном слое шесть электронов, четыре электрона дают два атома кислорода; в молекуле две π-связи которые вычитаются при определении n+m).
Атом серы имеет шесть валентных электронов. Из них четыре идут на образование π- и σ-связей с двумя атомами кислорода (О= S= O). В результате, у атома серы остается одна неподелённая пара электронов.
Строение карбонат-иона – плоский треугольник.
Задачи для самостоятельного решения
1. Из приведенных молекул полярными являются:
Что такое дипольный момент в химии
Виктор Александрович КОГАН
профессор, заведующий кафедрой физической и коллоидной химии
Ростовского Государственного Университета
ИЗБРАННЫЕ ЛЕКЦИИ ПО КУРСУ «МЕТОДЫ ИССЛЕДОВАНИЯ КООРДИНАЦИОННЫХ СОЕДИНЕНИЙ»
Метод дипольных моментов в химии
Лекция посвящена одному из важнейших физических методов исследования строения вещества – методу дипольных моментов. Рассмотрена природа дипольного момента и методы его определения, а также приведены отдельные примеры применения метода дипольных моментов для выяснения строения химических соединений.
1. Общие представления о природе дипольного момента
Дипольный момент – важная молекулярная константа, характеризующая электрическую симметрию молекулы.
Знание величины дипольного момента необходимо для изучения природы химической связи, оценки прочности донорно-акцепторных и межмолекулярных связей, для квантово-химических расчетов. По величине дипольного момента можно судить об изомерии и конформации органических соединений, конфигурации координационных узлов комплексов, о взаимном влиянии атомов и связей в молекуле.
Величина электрического дипольного момента (μ) определяется соотношением:
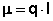
Причиной появления дипольного момента являются несколько факторов. В первую очередь – это различия в природе составляющих молекулу атомов. В простейшем случае для двухатомной молекулы μ = 0, если она состоит из двух одинаковых атомов. Это относится к H2, O2, N2 и т.д. В двухатомной молекуле с атомами разной природы проявляется постоянный дипольный момент, т. к., вследствие разной электроотрицательности, характеризующей способность атома оттягивать электронную плотность, появляется асимметрия электронной плотности. Другие причины – разные гибридные состояния орбиталей атомов. Так, например, для связи H-Cl, образованной 1s-орбиталью водорода и 3p-орбиталью хлора, вследствие различной формы s- и p-орбиталей, центр тяжести заряда перекрывания смещен в сторону водорода на ΔL, за счет чего возникает дополнительный, т. н. гомеополярный дипольный момент (рис.1):
Рис. 1. Схема происхождения гомеополярного диполя.
Естественно, молекулы HCl, HBr, HI имеют постоянные дипольные моменты, равные, соответственно, 1.95 D, 0.79 D, 0.40 D. Другие вклады в суммарный дипольный момент возникают из-за асимметрии связывающей и несвязывающей атомных орбиталей вследствие их гибридизации. Так, дипольный момент аммиака, 1.46 D, в основном обусловлен моментом несвязывающей пары электронов азота.
2. Методы определения дипольных моментов
Из всех методов получили наиболее широкое распространение методы определения дипольных моментов, основанные на измерении диэлектрической проницаемости (ε) вещества. Этими методами измерены дипольные моменты молекул более 10000 веществ. Переход от измеряемого значения ε газа, чистой жидкости или разбавленного раствора, т.е. макроскопической характеристики диэлектрика, к величине дипольного момента основан на теории поляризации диэлектриков. Считается, что при наложении электрического поля на диэлектрик его полная поляризация Р складывается из наведенной или индуцированной поляризации Рм и поляризации Рор и связана с μ уравнением Ланжевена-Дебая (2).
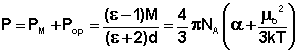
Измерения диэлектрической проницаемости проводят в постоянном поле или при низких частотах, обеспечивающих полную ориентацию молекул по полю. Кратко остановимся на типичной процедуре определения μо в разбавленных растворах. Она основана на предположении об аддитивности свойств составляющих раствор компонентов:
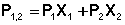
где Р1,2, Р1, Р2 – молекулярные поляризации раствора, растворителя и растворенного вещества соответственно;
Х1, Х2 – мольные доли растворителя и растворенного вещества.
С учетом уравнения (2) уравнение (3) для раствора будет выглядеть как (4):
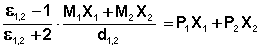
где М1 и М2 – молекулярные веса растворителя и растворенного вещества;
ε1,2 – диэлектрическая проницаемость раствора;
d1,2 – плотность раствора.
Из уравнения (4) можно вычислить Р2 – молекулярную поляризацию растворенного вещества. В этом методе допускается, что молекулы полярного вещества могут вести себя в растворах как в парообразном состоянии и свободно ориентироваться в приложенном поле только для бесконечно разбавленных растворов, поэтому значение Р2 следует экстраполировать на нулевую концентрацию (Х2 = 0) и найти значение молекулярной поляризации растворенного вещества при бесконечном разбавлении (Р2∞).
Эксперимент сводится к измерению диэлектрической проницаемости и плотности 5-7 разбавленных растворов исследуемого соединения при точно поддерживаемой температуре (обычно 25 °С) в интервале концентраций растворенного вещества от 0,001¸ 0,01 мольных долей. Выбор интервала концентраций зависит от растворимости и полярности вещества и может колебаться в сторону уменьшения мольных долей для более полярных соединений. Затем по формуле (4) находят значение молекулярной поляризации растворенного вещества для каждой концентрации и по полученным данным строят кривую зависимости Р2 от концентраций, по которой экстраполируют Р2 до нулевой концентрации и находят значение Р2∞. Эту величину можно также получить, используя различные приемы экстраполяции к нулевой концентрации для диэлектрической проницаемости и плотности.
Величину дипольного момента рассчитывают из уравнения Дебая (2)
из которого, подставляя значения N, κ, π, можно вычислить величину постоянного дипольного момента по формуле (5):
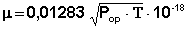
Найденное в эксперименте значение Р2∞ включает в себя электронную (Рэл) и атомную (Рат) молекулярные поляризации и поэтому Рор в уравнении (5) вычисляется как Рор = Р2∞ – Рат – Рэл.
Рэл считают равной рефракции вещества, которое вычисляется по той же схеме аддитивности на основании измерения коэффициентов преломления и плотности той же серии растворов, а Рат вследствие ее малости очень часто пренебрегают. Следует отметить, что Рэл можно рассчитать по рефракциям связей и групп, если не требуется высокая точность в значении дипольного момента.
Сходимость результатов, полученных различными методами при корректном использовании правильных расчетных формул бывает достаточно хорошей, как показано в табл. 1:
Таблица 1. Дипольные моменты молекул (в D)
Дипольный момент: как он рассчитывается и примеры
Содержание:
Дипольный момент μ является векторной величиной, поэтому на него влияют углы связей и, в целом, молекулярная структура.
Когда молекула линейна, ее можно сравнить с двухцветным ластиком. Его отрицательный конец δ- будет соответствовать красному цвету; в то время как положительное, δ +, будет синим цветом. По мере увеличения величин отрицательных зарядов на δ-полюсе и расстояния, отделяющего его от δ +, дипольный момент увеличивается.
С химической точки зрения это означает, что чем больше разница в электроотрицательности между двумя атомами и чем больше расстояние, которое их разделяет, тем больше дипольный момент между ними.
Как рассчитывается дипольный момент?
Считается ковалентной связью между двумя атомами, A и B:
Расстояние между положительным и отрицательным частичными зарядами уже определяется длиной их связи:
Но поскольку это значение очень мало, используется единица Дебая:
Это значение μA-B может привести к предположению, что связь A-B является более ионной, чем ковалентной.
Примеры
вода
Чтобы вычислить дипольный момент молекулы, все дипольные моменты их соответствующих связей должны быть добавлены векторно, учитывая валентные углы и небольшую тригонометрию. Это в самом начале.
Вода имеет один из самых больших дипольных моментов, который можно ожидать для ковалентного соединения. На верхнем изображении мы видим, что атомы водорода имеют положительный частичный заряд, δ +, а кислород несет отрицательный частичный заряд, δ-. Связь O-H достаточно полярна (1,5D), и их две в молекуле H2ИЛИ.
Обычно рисуется вектор, направленный от наименее электроотрицательного атома (H) к наиболее электроотрицательному (O). Хотя они не нарисованы, на атоме кислорода есть две пары неподеленных электронов, которые еще больше «концентрируют» отрицательную область.
Из-за угловой геометрии H2Или дипольные моменты складываются в направлении атома кислорода. Обратите внимание, что сумма двух μO-H даст 3D (1,5 + 1,5); но это не так. Дипольный момент воды имеет экспериментальное значение 1,85D. Здесь показан эффект угла около 105 ° между связями H-O-H.
Метанол
Дипольный момент метанола составляет 1,69 D. Это меньше, чем у воды. Следовательно, атомные массы не имеют большого влияния на дипольный момент; но их атомные радиусы равны. В случае метанола мы не можем утверждать, что его связь H-O имеет μ, равную 1,5D; так как в CH3ОН и Н2ИЛИ.
Вот почему вам нужно будет измерить длину связи H-O в метаноле, чтобы рассчитать μO-H. Что можно сказать, так это то, что μO-H больше, чем μC-O, поскольку разница электроотрицательностей между углеродом и кислородом меньше, чем между водородом и кислородом.
Метанол указан как один из самых полярных растворителей, которые можно найти вместе с водой и аммиаком.
Аммиак
Связи H-N довольно полярны, поэтому азот из-за своей более высокой электроотрицательности притягивает электроны к себе (верхнее изображение). В дополнение к этому у нас есть неподеленная пара электронов, которые вносят свои отрицательные заряды в δ-область. Следовательно, на атоме азота аммиака преобладают электрические заряды.
Аммиак имеет дипольный момент 1,42D, меньше, чем у метанола. Если бы и аммиак, и метанол можно было превратить в ластики, было бы видно, что ластик из метанола имеет более определенные полюса по сравнению с ластиком из аммиака.
Этанол
В случае этанола CH3CH2ОН, его дипольный момент очень близок к дипольному моменту метанола, но, как правило, имеет более низкие значения. Поскольку в области δ + становится больше атомов углерода, атом кислорода, представляющий δ-, начинает терять часть своей «относительной отрицательной интенсивности».
Углекислый газ
Углекислый газ имеет две полярные связи C = O с соответствующими дипольными моментами μO-C. Однако, как видно на изображении выше, линейная геометрия CO2 Это заставляет два μO-C векторно компенсировать друг друга, даже когда углерод имеет положительный частичный заряд, а атомы кислорода имеют отрицательный частичный заряд.
По этой причине диоксид углерода является неполярной молекулой, поскольку μCO2 имеет значение 0D.
Метан
Если мы увидим молекулу CH4, его связи C-H полярны, а электроны направлены к атому углерода, потому что он немного более электроотрицателен. Можно было бы подумать, что углерод должен быть сильно отрицательной δ-областью; как ластик с темно-красным центром и голубоватыми концами.
Однако, разделив CH4 в середине мы получили бы две половинки H-C-H, одну слева, а другую справа, аналогичные молекуле H2О. Таким образом, дипольный момент, возникающий в результате сложения этих двух мкС-Н, компенсируется дипольным моментом другой половины. Следовательно, μCH4 имеет значение 0D.