что такое динамическое равновесие в физике
Равновесие тел. Виды равновесия тел
Виды равновесия тел
Это происходит, если при небольшом смещении тела в любом направлении от первоначального положения равнодействующая сил, действующих на тело, становится отличной от нуля и направлена к положению равновесия. Например, шарик, лежащий на дне сферического углубления (рис.1 а).
В данном случае при небольшом смещении тела из положения равновесия равнодействующая приложенных к нему сил отлична от нуля и направлена от положения равновесия. Примером может служить шарик, находящийся в верхней точке выпуклой сферической поверхности (ри.1 б).
В этом случае при небольших смещениях тела из первоначального положения равнодействующая приложенных к телу сил остается равной нулю. Например, шарик, лежащий на плоской поверхности (рис.1,в).
Рис.1. Различные типы равновесия тела на опоре: а) устойчивое равновесие; б) неустойчивое равновесие; в) безразличное равновесие.
Статическое и динамическое равновесие тел
Если в результате действия сил тело не получает ускорения, оно может находиться в состоянии покоя или двигаться равномерно прямолинейно. Поэтому можно говорить о статическом и динамическом равновесии.
Динамическое равновесие — это такое равновесие, когда по действием сил тело не изменяет своего движения.
В состоянии статического равновесия находится подвешенный на тросах фонарь, любое строительное сооружение. В качестве примера динамического равновесия можно рассматривать колесо, которое катится по плоской поверхности при отсутствии сил трения.
Динамическое равновесие
* Динамическое равновесие — в живой природе: состояние относительного равновесия экологических систем, находящихся под действием как внутренних так и внешних сил (техногенных, антропогенных и др.)
* Динамическое равновесие — равновесие в биологической среде
* Динамическое равновесие — химическое равновесие
* Динамическое равновесие — термодинамическое равновесие: состояние системы, при котором остаются неизменными во времени макроскопические величины этой системы (температура, давление, объём, энтропия) в условиях изолированности от окружающей среды
* Динамическое равновесие — равновесие твёрдого тела.
Связанные понятия
Упоминания в литературе
Связанные понятия (продолжение)
Голономное движение англ. holonomic movement — ключевое понятие в интерпретации квантовой механики Дэвида Бома. Оно объединяет в себе холистический принцип «неразделимого целого» с идеей, что всё находится в процессе становления (или, по его словам, являет собой «космическую ткань»). По Бому, целое — это не статичное единичное, но динамичная цельность-в-движении, в которой всё движется одновременно во взаимосвязанном процессе. Данная концепция наиболее явно представлена в работе Wholeness and the.
Гештáльтпсихолóгия (от нем. Gestalt — личность, образ, форма) — это общепсихологическое направление, которое связано с попытками объяснения прежде всего восприятия, мышления и личности. В качестве основного объяснительного принципа гештальтпсихология выдвигает принцип целостности. Основана Максом Вертгеймером, Вольфгангом Кёлером и Куртом Коффкой в 1912 году.
В теории твердого тела, термин геометрическая фрустрация (или просто фрустрация, значению этого термина в психологии посвящена другая статья, см. фрустрация) означает явление, при котором геометрические свойства кристаллической решетки.
В физике, при рассмотрении нескольких систем отсчёта (СО), возникает понятие сложного движения — когда материальная точка движется относительно какой-либо системы отсчёта, а та, в свою очередь, движется относительно другой системы отсчёта. При этом возникает вопрос о связи движений точки в этих двух системах отсчета (далее СО).
Принципами механики называются исходные положения, отражающие столь общие закономерности механических явлений, что из них как следствия можно получить все уравнения, определяющие движение механической системы (или условия её равновесия). В ходе развития механики был установлен ряд таких принципов, каждый из которых может быть положен в основу механики, что объясняется многообразием свойств и закономерностей механических явлений. Эти принципы подразделяют на невариационные и вариационные.
Испарение, конденсация, кипение. Насыщенные и ненасыщенные пары
У всех веществ есть три агрегатных состояния – твердое, жидкое и газообразное, которые проявляются при особых условиях.
Фазовый переход – это переход вещества от одного состояния к другому.
Примерами такого процесса являются конденсация и испарение.
Испарение – это фазовый переход вещества в газообразное состояние из жидкого.
Молекулярно-кинетическая теория объясняет этот процесс постепенным перемещением с поверхности жидкости тех молекул, чья кинетическая энергия больше, чем энергия их связи с остальными молекулами жидкого вещества. Вследствие испарения средняя кинетическая энергия оставшихся молекул уменьшается, что, в свою очередь, приводит к снижению температуры жидкости, если к ней не подведен дополнительный источник внешней энергии.
Конденсация – это фазовый переход вещества из газообразного состояния в жидкое (процесс, обратный испарению).
Во время конденсации молекулы пара возвращаются обратно в жидкое состояние.
Динамическое равновесие
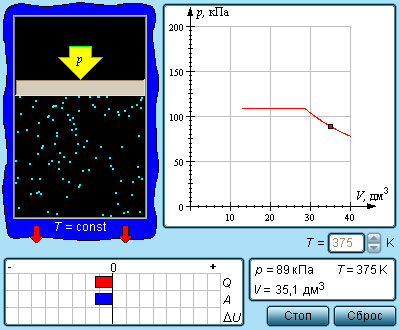
Если сосуд, в котором находится жидкость или газ, закупорен, то в таком случае его содержимое может находиться в динамическом равновесии, т.е. скорость процессов конденсации и испарения будет одинаковой (из жидкости будет испаряться столько молекул, сколько возвращается обратно из пара). Такая система получила название двухфазной.
Насыщенный пар – это пар, который находится со своей жидкостью в состоянии динамического равновесия.
Существует зависимость между количеством молекул, испаряющихся с поверхности жидкости в течение одной секунды, и температурой этой жидкости. Скорость процесса конденсации зависит от концентрации молекул пара и скорости их теплового движения, которая, в свою очередь, также находится в прямой зависимости от температуры. Следовательно, можно сделать вывод, что при равновесии жидкости и ее пара концентрация молекул будет определяться равновесной температурой. При повышении температуры необходима высокая концентрация молекул пара, чтобы испарение и конденсация стали одинаковыми по скорости.
Поскольку, как мы уже выяснили, концентрация и температура будут определять давление пара (газа), мы можем сформулировать следующее утверждение:
Давление насыщенного пара p 0 определенного вещества не зависит от объема, но находится в прямой зависимости от температуры.
Именно по этой причине изотермы реальных газов на плоскости включают в себя горизонтальные фрагменты, которые соответствуют двухфазной системе.
Если температура будет расти, увеличатся и давление насыщенного пара, и его плотность, а вот плотность жидкости, наоборот, будет снижаться из-за теплового расширения. При достижении критической для данного вещества температуры плотность жидкости и газа уравниваются, после прохождения этой точки физические различия между насыщенным паром и жидкостью исчезают.
Воздух, которым мы дышим, при некотором давлении всегда включает в себя водяные пары. Это давление, как правило, меньше, чем давление насыщенного пара.
Относительная влажность воздуха – это отношение парциального давления к давлению насыщенного водяного пара.
В виде формулы это можно записать так:
Для описания ненасыщенного пара допустимо использовать и уравнение состояния идеального газа с учетом обычных для реального газа ограничений: не слишком большого давления пара ( p ≤ ( 10 6 – 10 7 ) П а ) и температуры выше значения, определенного для каждого конкретного вещества.
Для описания насыщенного пара применимы законы идеального газа. Однако при этом давление для каждой температуры должно быть определено по кривой равновесия для данного вещества.
Чем выше температура, тем выше давление насыщенного пара. Эту зависимость из законов идеального газа вывести нельзя. При условии постоянной концентрации молекул давление газа будет постоянно возрастать прямо пропорционально температуре. Если пар является насыщенным, то с ростом температуры будет расти не только концентрация, но и средняя кинетическая энергия молекул. Из этого следует, что чем выше температура, тем быстрее растет давление насыщенного пара. Этот процесс происходит быстрее, чем рост давления идеального газа при условии постоянной концентрации молекул в нем.
Что такое кипение
Выше мы указывали, что испарение идет в основном с поверхности, но оно также может происходить и из основного объема жидкости. Любое жидкое вещество включает в себя мелкие газовые пузырьки. Если внешнее давление (т.е. давление газа в них) уравнять с давлением насыщенного пара, то произойдет испарение жидкости внутри пузырьков, и они начнут наполняться паром, расширяться и всплывать на поверхность. Этот процесс называется кипением. Таким образом, температура кипения зависит от внешнего давления.
Жидкость начинает кипеть при такой температуре, при которой внешнее давление и давление ее насыщенных паров будут равны.
Жидкость может кипеть только в открытом сосуде. Если его герметично закрыть, то нарушится равновесие между жидкостью и ее насыщенным паром. Узнать температуру кипения при различных значениях давления можно с помощью кривой равновесия.
Кривые равновесия состояний вещества
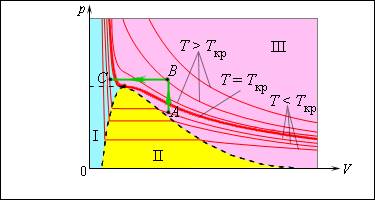
На изображении выше с помощью изотерма реального газа показаны процессы фазовых переходов – конденсации и испарения. Эта схема является неполной, поскольку вещество может принимать также и твердое состояние. Достижение термодинамического равновесия между фазами вещества при заданной температуре возможно лишь при определенном давлении в системе.
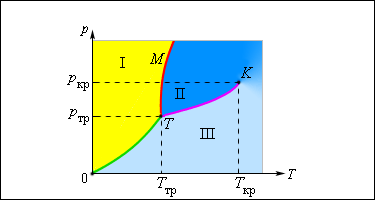
Кривая фазового равновесия – это зависимость между равновесным давлением и температурой.
Примером такой зависимости может быть кривая равновесия жидкости и насыщенного пара. Если мы построим кривые, отображающие равновесие между фазами одного вещества, на плоскости, то мы увидим определенные области, которые соответствуют разным агрегатным состояниям вещества – жидкому, твердому, газообразному. Кривые, построенные в системе координат, называются фазовыми диаграммами.
Равновесие между газообразной и твердой фазой вещества отображает так называемая кривая сублимации (на рисунке она обозначена как 0 T ), между паром и жидкостью – кривая испарения, которая заканчивается в критической точке. Кривая равновесия между жидкостью и твердым телом называется кривой плавления.
Тройная точка – это точка, в которой сходятся все кривые равновесия, т.е. возможны все фазы вещества.
Насыщенный пар
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: насыщенные и ненасыщенные пары, влажность воздуха.
Если открытый стакан с водой оставить на долгое время, то в конце концов вода полностью улетучится. Точнее — испарится. Что такое испарение и почему оно происходит?
Испарение и конденсация
При данной температуре молекулы жидкости обладают разными скоростями. Скорости большинства молекул находятся вблизи некоторого среднего значения (характерного для этой температуры). Но попадаются молекулы, скорости которых значительно отличаются от средней как в меньшую, так и большую сторону.
На рис. 1 изображён примерный график распределения молекул жидкости по скоростям. Голубым фоном показано то самое большинство молекул, скорости которых группируются около среднего значения. Красный «хвост» графика — это небольшое число «быстрых» молекул, скорости которых существенно превышают среднюю скорость основной массы молекул жидкости.
Рис. 1. Распределение молекул по скоростям
Когда такая весьма быстрая молекула окажется на свободной поверхности жидкости (т.е. на границе раздела жидкости и воздуха), кинетической энергии этой молекулы может хватить на то, чтобы преодолеть силы притяжения остальных молекул и вылететь из жидкости. Данный процесс и есть испарение, а молекулы, покинувшие жидкость, образуют пар.
Итак, испарение — это процесс превращения жидкости в пар, происходящий на свободной поверхности жидкости (при особых условиях превращение жидкости в пар может происходить по всему объёму жидкости. Данный процесс вам хорошо известен — это кипение).
Может случиться, что через некоторое время молекула пара вернётся обратно в жидкость.
Процесс перехода молекул пара в жидкость называется конденсацией. Конденсация пара — процесс, обратный испарению жидкости.
Динамическое равновесие
А что будет, если сосуд с жидкостью герметично закрыть? Плотность пара над поверхностью жидкости начнёт увеличиваться; частицы пара будут всё сильнее мешать другим молекулам жидкости вылетать наружу, и скорость испарения станет уменьшаться. Одновременно начнёт увеличиваться скорость конденсации, так как с возрастанием концентрации пара число молекул, возвращающихся в жидкость, будет становиться всё больше.
Наконец, в какой-то момент скорость конденсации окажется равна скорости испарения. Наступит динамическое равновесие между жидкостью и паром: за единицу времени из жидкости будет вылетать столько же молекул, сколько возвращается в неё из пара. Начиная с этого момента количество жидкости перестанет убывать, а количество пара — увеличиваться; пар достигнет «насыщения».
Насыщенный пар — это пар, который находится в состоянии динамического равновесия со своей жидкостью. Пар, не достигший состояния динамического равновесия с жидкостью, называется ненасыщенным.
Свойства насыщенного пара
Оказывается, что состояние насыщенного пара (а ненасыщенного — тем более) можно приближённо описывать уравнением состояния идеального газа (уравнением Менделеева — Клапейрона). В частности, имеем приближённое соотношение между давлением насыщенного пара и его плотностью:
Это весьма удивительный факт, подтверждаемый экспериментом. Ведь по своим свойствам насыщенный пар существенно отличается от идеального газа. Перечислим важнейшие из этих отличий.
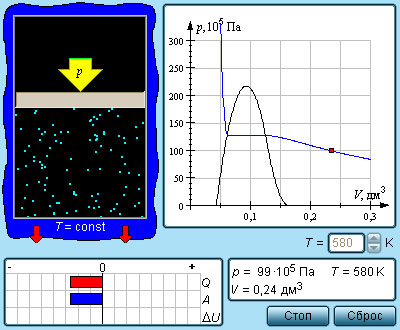
1. При неизменной температуре плотность насыщенного пара не зависит от его объёма.
Если, например, насыщенный пар изотермически сжимать, то его плотность в первый момент возрастёт, скорость конденсации превысит скорость испарения, и часть пара конденсируется в жидкость — до тех пор, пока вновь не наступит динамическое равновесие, в котором плотность пара вернётся к своему прежнему значению.
Аналогично, при изотермическом расширении насыщенного пара его плотность в первый момент уменьшится (пар станет ненасыщенным), скорость испарения превысит скорость конденсации, и жидкость будет дополнительно испаряться до тех пор, пока опять не установится динамическое равновесие — т.е. пока пар снова не станет насыщенным с прежним значением плотности.
2. Давление насыщенного пара не зависит от его объёма.
Как видим, закон Бойля — Мариотта, справедливый для идеальных газов, для насыщенного пара не выполняется. Это и не удивительно — ведь он получен из уравнения Менделеева — Клапейрона в предположении, что масса газа остаётся постоянной.
3. При неизменном объёме плотность насыщенного пара растёт с повышением температуры и уменьшается с понижением температуры.
Действительно, при увеличении температуры возрастает скорость испарения жидкости.
Динамическое равновесие в первый момент нарушается, и происходит дополнительное испарение некоторой части жидкости. Пара будет прибавляться до тех пор, пока динамическое равновесие вновь не восстановится.
Точно так же при понижении температуры скорость испарения жидкости становится меньше, и часть пара конденсируется до тех пор, пока не восстановится динамическое равновесие — но уже с меньшим количеством пара.
Таким образом, при изохорном нагревании или охлаждении насыщенного пара его масса меняется, поэтому закон Шарля в данном случае не работает. Зависимость давления насыщенного пара от температуры уже не будет линейной функцией.
4. Давление насыщенного пара растёт с температурой быстрее, чем по линейному закону.
В самом деле, с увеличением температуры возрастает плотность насыщенного пара, а согласно уравнению (1) давление пропорционально произведению плотности на температуру.
Зависимость давления насыщенного пара от температуры является экспоненциальной (рис. 2 ). Она представлена участком 1–2 графика. Эту зависимость нельзя вывести из законов идеального газа.
Рис. 2. Зависимость давления пара от температуры
В точке 2 вся жидкость испаряется; при дальнейшем повышении температуры пар становится ненасыщенным, и его давление растёт линейно по закону Шарля (участок 2–3).
Вспомним, что линейный рост давления идеального газа вызван увеличением интенсивности ударов молекул о стенки сосуда. В случае нагревания насыщенного пара молекулы начинают бить не только сильнее, но и чаще — ведь пара становится больше. Одновременным действием этих двух факторов и вызван экспоненциальный рост давления насыщенного пара.
Влажность воздуха
Воздух, содержащий водяной пар, называется влажным.Чем больше пара находится в воздухе, тем выше влажность воздуха.
Абсолютная влажность — это парциальное давление водяного пара, находящегося в воздухе (т. е. давление, которое водяной пар оказывал бы сам по себе, в отсутствие других газов). Иногда абсолютной влажностью называют также плотность водяного пара в воздухе.
Относительная влажность воздуха — это отношение парциального давления водяного пара в нём к давлению насыщенного водяного пара при той же температуре. Как правило, это отношение выражают в процентах:
Одним из приборов, измеряющих влажность воздуха, является психрометр. Он включает в себя два термометра, резервуар одного из которых завёрнут в мокрую ткань. Чем ниже влажность, тем интенсивнее идёт испарение воды из ткани, тем сильнее охлаждается резервуар «мокрого» термометра, и тем больше разность его показаний и показаний сухого термометра. По этой разности с помощью специальной психрометрической таблицы определяют влажность воздуха.
В химия, И в физика, а динамическое равновесие существует однажды обратимая реакция происходит. Вещества переходят между реагентами и продуктами с одинаковой скоростью, что означает отсутствие чистых изменений. Реагенты и продукты образуются с такой скоростью, что их концентрация не меняется. Это частный пример системы в устойчивое состояние. В термодинамика, а закрытая система в термодинамическое равновесие когда реакции происходят с такой скоростью, что состав смеси не меняется со временем. Реакции действительно происходят, иногда бурно, но до такой степени, что изменения в составе невозможно наблюдать. Константы равновесия могут быть выражены через константы скорости обратимых реакций.
Содержание
Примеры
В новой бутылке газировки концентрация углекислый газ в жидкой фазе имеет особое значение. Если вылить половину жидкости и закрыть бутылку, углекислый газ будет выходить из жидкой фазы с постоянно уменьшающейся скоростью, и частичное давление диоксида углерода в газовой фазе будет увеличиваться до тех пор, пока не будет достигнуто равновесие. В этот момент из-за теплового движения молекула CO2 может покинуть жидкую фазу, но в течение очень короткого времени другая молекула CO2 перейдет из газа в жидкость и наоборот. При равновесии скорость переноса CO2 от газа к жидкой фазе равна скорости перехода от жидкости к газу. В этом случае равновесная концентрация CO2 в жидкости определяется выражением Закон Генри, который утверждает, что растворимость газа в жидкости прямо пропорциональна частичное давление этого газа над жидкостью. [1] Это отношение записывается как
Закон Генри можно вывести, установив химические потенциалы диоксида углерода в двух фазах равны друг другу. Равенство химического потенциала определяет химическое равновесие. Другие константы динамического равновесия, включающие фазовые изменения, включают: Коэффициент распределения и произведение растворимости. Закон Рауля определяет равновесие давление газа из идеальное решение
Динамическое равновесие может существовать и в однофазной системе. Простой пример происходит с кислотно-щелочной равновесие, такое как диссоциация уксусная кислота, в водном растворе.
В состоянии равновесия концентрация частное K, то константа диссоциации кислоты, постоянно (при некоторых условиях)
В этом случае прямая реакция предполагает высвобождение некоторых протоны от молекул уксусной кислоты, и обратная реакция включает образование молекул уксусной кислоты, когда ацетат-ион принимает протон. Равновесие достигается, когда сумма химических потенциалов компонентов в левой части выражения равновесия равна сумме химических потенциалов компонентов в правой части. При этом скорости прямой и обратной реакции равны между собой. Равновесия с образованием химические комплексы также являются динамическими равновесиями, а концентрации регулируются константы устойчивости комплексов.
В газовой фазе также могут возникать динамические равновесия, например, когда диоксид азота димеризуется.
В газовой фазе квадратные скобки указывают парциальное давление. В качестве альтернативы парциальное давление вещества можно записать как P (вещество). [2]
Связь между константами равновесия и скоростью
В простой реакции, такой как изомеризация:
необходимо рассмотреть две реакции: прямая реакция, в которой компонент A превращается в B, и обратная реакция, в которой B превращается в A. Если обе реакции элементарные реакции, то скорость реакции дан кем-то [3]
Решение этого дифференциального уравнения есть
и показан справа. Когда время стремится к бесконечности, концентрации [A]т и [B]т стремятся к постоянным значениям. Позволять т приближаются к бесконечности, то есть т→ ∞ в приведенном выше выражении:
K = [ B ] е q [ А ] е q < Displaystyle К = < гидроразрыва <[B] _
Отсюда следует, что константа равновесия численно равна отношению констант скорости.
K = k ж k ж + k б [ А ] 0 k б k ж + k б [ А ] 0 = k ж k б < displaystyle K = < frac << frac
Как правило, это может быть более одной прямой реакции и более одной обратной реакции. Аткинс заявляет [4] что для общей реакции общая константа равновесия связана с константами скорости элементарных реакций соотношением
K = ( k ж k б ) 1 × ( k ж k б ) 2 … < displaystyle K = left (< frac