что такое дилатация внепеченочных желчных протоков
Что такое дилатация внепеченочных желчных протоков
1. Общая характеристика:
• Основные диагностические признаки:
о Тубулярные анэхогенные заполненные жидкостью структуры, сопутствующие ветвям воротной вены в их внутрипеченочных и внепеченочных сегментах
• Локализация:
о Внутрипеченочные и внепеченочные желчные протоки
2. УЗИ при дилатации желчных путей:
• УЗИ в черно-белом режиме
о Дилатация внутрипеченочных протоков
— Диаметр протоков > 2 мм
— Тубулярные анэхогенные ветвящиеся структуры, сопутствующие воротным венам:
Симптом «параллельного канала»
Зачастую самыми первыми из внутрипеченочных протоков расширяются протоки левой доли печени
— Расширенные протоки могут быть извитыми и иметь неравномерный просвет
— Проксимально у ворот печени сливающиеся тубулярные структуры формируют звездчатую структуру
о Дилатация внепеченочных протоков:
— Диаметр общего желчного протока > 6-7 мм или более чем 40% диаметра прилегающей воротной вены
— Анэхогенная тубулярная структура, в воротах печени параллельная основному стволу воротной вены и перпендикулярная печеночной артерии
— Расширение протоков может распространяться на внутрипеченочные протоки
• Цветовая допплерография:
о Позволяют достоверно дифференцировать расширенные протоки (в которых отсутствуют признаки кровотока) от прилегающих сосудистых ветвей печеночной артерии и воротной вены
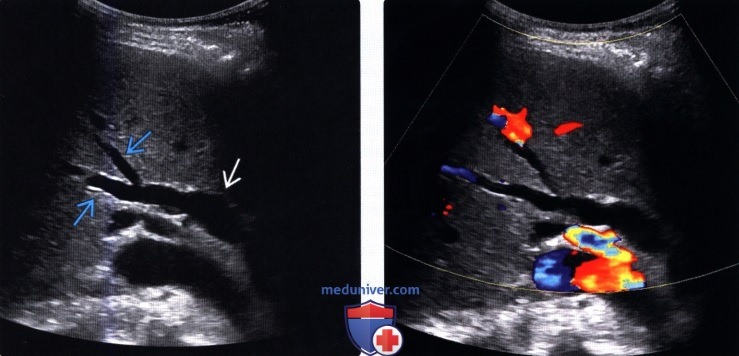
(Правый) При цветовой допплерографии у того же пациента отмечается отсутствие кровотока в расширенных тубулярных структурах, что указывает на то, что это и в самом деле расширенные желчные протоки. Следует выполнять цветовую допплерографию в повседневной практике для подтверждения дилатации желчных протоков.
3. КТ при дилатации желчных путей:
• В паренхиме печени определяются прилегающие к внутрипеченочным ветвям воротной вены тубулярные структуры с близком к нулю коэффициентом ослабления
• Между печенью и двенадцатиперстной кишкой внутрипеченочные протоки сообщаются с тубулярными структурами, имеющими близкий к нулю коэффициентом ослабления
4. МРТ при дилатации желчных путей:
• Т2-гиперинтенсивные тубулярные структуры в паренхиме печени
• Внутрипеченочные протоки сообщаются с Т2-гиперинтенсивными тубулярными структурами между печенью и двенадцатиперстной кишкой
5. Рекомендации по визуализации:
• Оптимальный метод визуализации:
о Трансабдоминальное УЗИ используется в качестве первичного метода исследования для оценки степени, протяженности и причины обструкции желчных путей
о Под контролем УЗИ возможно проведение других инвазивных вмешательств
о КТ и МРТ позволяют получить более подробную информацию об анатомических изменениях и причине заболевания
• Рекомендации по методике проведения исследования:
о Методика УЗИ:
— Включает в себя подробное исследование в сагиттальной, поперечной и косой плоскостях, межреберный и субкостальный УЗ-доступы
— Внутрипеченочные протоки лучше визуализируются при глубоком вдохе
— Экранирующее действие кишечных газов минимально при положении пациента лежа на правом боку или полулежа в полусупинированном на правом боку положении
— Гармоническое изображение обеспечивает более детальную визуализацию расширенных протоков и их содержимого
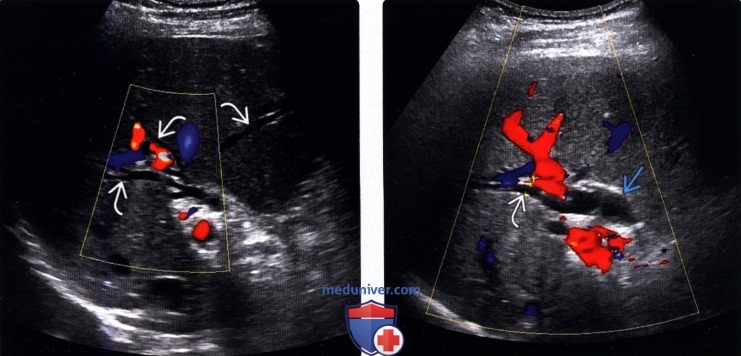
(Правый) При цветовой допплерографии на поперечном УЗ срезе печени наблюдается небольшое расширение внутрипеченочных и внепеченочных протоков. У пациента был диагностирован стеноз ампулы в сочетании с холангитом, которые стали причиной дилатации желчных протоков.
б) Дифференциальная диагностика дилатации желчных путей:
1. Кавернома воротной вены:
• Кавернозная трансформация воротной вены; рацемозный конгломерат коллатеральных вен
• При цветовой допплерографии определяется кровоток в системе воротной вены
2. Тромбоз ветви воротной вены:
• Гипоэхогенный (острый) или эхогенный (хронический) дефект заполнения просвета основного ствола воротной вены и ее ветвей
• Цветовая допплерография: фрагментарный кровоток или полное отсутствие кровообращения
3. Вено-венозные коллатерали:
• Коллатерали между тромбированными/стенозированными печеночными венами и нормальными печеночными венами/во-ротной веной
• Цветовая допплерография: венозный кровоток
• Наблюдается при синдроме Бадда-Киари
4. Перибилиарные кисты:
• Мелкие кисты вдоль печеночных триад
5. Кисты холедоха:
• Врожденные кистозные расширения желчных путей
в) Патология. Общая характеристика:
• Этиология:
о Необструктивные причины:
— Пожилой возраст
— Перенесенная ранее холецистэктомия
— Врожденная патология (например, киста холедоха)
— Стеноз печеночной артерии у пациентов после трансплантации печени
о Обструктивные причины:
— Внутрипеченочные: конкремент, склерозирующий/СПИД-ассоциированный холангит, рецидивирующий пиогенный холангит, восходящий холангит, холангиокарцинома, травма и т.д.
— Внепеченочные: конкремент общего желчного протока, аденокарцинома головки поджелудочной железы, холангиокарцинома, сдавливание лимфоузлом, стриктура, стеноз ампулы и т.д.
г) Клинические особенности. Проявления:
• Зависит от вызвавшего дилатацию заболевания (например, острый холангит: боли в правом верхнем квадранте живота, лихорадка с ознобом)
• Механическая желтуха: безболезненная или сопровождающаяся болями в правом верхнем квадранте живота
Редактор: Искандер Милевски. Дата обновления публикации: 22.1.2020
Заболевания желчевыводящих путей
ЖЕЛЧНОКАМЕННАЯ БОЛЕЗНЬ (ЖКБ)
— заболевание, обусловленное нарушением обмена холестерина и билирубина, характеризуется образованием камней в желчном пузыре, в желчных протоках с возможным развитием опасных для жизни осложнений.
Факторы, способствующие образованию холестериновых и смешанных желчных камней:
В 10-15% случаев камни в желчном пузыре диагностируют при профилактическом ультразвуковом исследовании органов брюшной полости. Развитие желчнокаменной болезни (ЖКБ) проходит несколько этапов.
Проявления ЖКБ зависят от размеров камней, их локализации и активности воспалительного процесса, проходимости желчевыделительной системы, а также от состояния других органов желудочно-кишечного тракта.
Варианты ЖКБ
Острый холецистит. Основной причиной развития заболевания является ущемление камня в пузырном протоке. Характеризуется лихорадкой и постоянными болями в правом подреберье. Типичные боли при остром холецистите имеют место менее чем у 50% больных. Чаще всего боль возникает вскоре после приема пищи и нарастает по интенсивности в течение часа и более. Лихорадка обычно присоединяется через 12 ч от начала приступа и связана с развитием воспаления. Боль становится постоянной. Бескаменный острый холецистит встречается крайне редко, может возникать вторично при сальмонеллезе, сепсисе и травме.
Осложнения острого холецистита.
Хронический калькулезный холецистит. Обычно характеризуется рецидивирующими приступами желчной колики, реже — постоянными болями. Развитие приступа провоцирует жирная пища, пряности, копчености, острые приправы, резкое физическое напряжение, работа в наклонном положении, а также инфекция. Реже колика возникает «беспричинно». Обычно сопровождается температурой, тошнотой, иногда рвотой. Боли усиливаются при движении, глубоком дыхании. Иногда боль отдает в область сердца, симулируя приступ стенокардии. Боль многообразна – от интенсивной режущей, до относительно слабой ноющей. Рвота при холецистите не приносит облегчения. У женщин колика иногда совпадает с менструацией или возникает после родов.
Холедохолитиаз (камни общего желчного протока) возникает при попадании камня из желчного пузыря в общий желчный проток. Симптоматика характеризуется болью в правом подреберье по типу желчной колики, лихорадкой, ознобом, желтухой и характерными изменениями в биохимии крови.
Холангит. Вариант течения желчнокаменной болезни сопровождающийся болями в верхней половине живота, желтухой, лихорадкой, нередко ознобами. Бактериальный холангит является одним из самых опасных осложнений ЖКБ, он обычно связан с холестазом, возникающим при закупорке камнем общего желчного протока. Тяжесть холангита зависит, прежде всего, от длительности холестаза и уровня холемии.
Гангрена и эмпиема желчного пузыря проявляются сепсисом, тяжелым состоянием больного с симптомами перитонита. Требует незамедлительной медицинской помощи. Эмпиема — острое гнойное воспаление желчного пузыря, характеризуется интоксикацией и высоким риском перфорации. Открытая перфорация в брюшную полость сопровождается перитонитом, обусловливая высокую летальность (до 25%).
Лечение: хирургическое. Абсолютные показания к операции:
ХРОНИЧЕСКИЙ БЕСКАМЕННЫЙ ХОЛЕЦИСТИТ (ХБХ)
Встречается гораздо реже, чем диагностируется. При наличии клиники хронического холецистита необходимо исключить, прежде всего, желчекаменную болезнь и паразитарные инвазии. ХБХ может вызываться микробной флорой. Инфекция может попадать в желчный пузырь из желудочно-кишечного тракта по общему желчному и пузырному протокам (восходящая инфекция). Возможно также и нисходящее распространение инфекции из внутрипеченочных желчных ходов. Развитию воспалительного процесса в желчном пузыре способствует застой желчи. ХБХ характеризуется длительным прогрессирующим течением с периодами ремиссий и обострений, ноющими болями в правом подреберье, реже — в подложечной области, продолжающимися в течение многих часов, дней, иногда недель. Возникновение или усиление боли связано с приемом жирной и жареной пищи, яиц, холодных и газированных напитков, вина, пива, острых закусок. Боли могут сочетаться с тошнотой, отрыжкой, вздутием живота, лихорадкой. Отмечается постоянное чувство тяжести в верхних отделах живота.
Лечение. Диета, дробное питание, обезболивающая, противовоспалительная и противопаразитарная терапия, прием ферментов.
ХОЛЕСТАТИЧЕСКАЯ (подпеченочная) ЖЕЛТУХА
Холестатическая желтуха развивается при возникновении препятствия току желчи на любом уровне желчевыводящей системы. Обструктивная или подпеченочная (механическая) желтуха развивается при препятствиях току желчи на уровне внепеченочных желчных протоков (камни холедоха, рак поджелудочной железы, хронический панкреатит, посттравматические сужения холедоха, псевдокисты поджелудочной железы и др.).
70% случаев связаны с камнями в холедохе и раком головки поджелудочной железы. Внутрипеченочный холестаз наиболее часто наблюдается при острых лекарственных гепатитах и первичном циррозе, реже при вирусном, алкогольном гепатите, холангите, циррозе печени, метастазах и др. Желтуха развивается медленно, часто ей предшествует кожный зуд. Он является типичным как для внепеченочного, так и для внутрипеченочного холестаза. Диагностические критерии:
При закупорке камнем желтуха развивается в течение суток после начала боли, а лихорадка присоединяется в связи с развивающимся холангитом. Кожный зуд встречается не у всех больных. В отличие от опухоли, длительная закупорка камнем редко бывает полной.
Диагностика: Лабораторные исследования крови, кала, мочи. Инструментальная диагностика: УЗИ, КТ, МРТ диагностика с контрастированием, Эндоскопическая диагностика.
ПОСТХОЛЕЦИСТЭКТОМНЫЙ СИНДРОМ
У 15% пациентов после эффективной холецистэктомии остаются или рецидивируют боли и диспепсические нарушения. Эти симптомы связаны с нарушением моторики сфинктера Одди, дискинезии внепеченочных желчных протоков и 12-перстной кишки. Основным признаками являются:
У больных нередко имеются дуоденогастральный рефлюкс, антральный гастрит, дуоденит, обусловливающих появление чувства тяжести и боли в эпигастрии, тошноты, горечи во рту, метеоризма, неустойчивого стула и др. Воспаление гастродуоденальной слизистой, как правило, связано с микробным фактором и с повреждающим действием желчных кислот.
Холестаз: симптомы и лечение холестатического синдрома
Холестаз – клинико-лабораторный синдром, при котором нарушена выработка желчи или полностью либо частично блокирован ее отток в двенадцатиперстную кишку.
Состояние может быть вызвано различными заболеваниями. Оно характеризуется накоплением в крови выводимых с желчью веществ, что сопровождается кожным зудом, слабостью, желтухой и другими проявлениями.
Диагностика патологии основана преимущественно на данных анализов, а также инструментальных методов исследования.
Лечение холестатического синдрома включает прием медикаментов, диету и в ряде случаев хирургическое вмешательство на органах печени и желчевыводящих путей.
Распространенность и особенности холестаза
По данным статистики, этой патологией страдает 1 человек на 10 тысяч населения планеты в год. При этом около 50-70% людей с заболеваниями печени и желчных путей (даже пролеченных ранее) может столкнуться в той или иной степени с холестазом в разные периоды жизни.
Большая часть заболевших мужского пола, в возрасте старше 40 лет. Среди беременных женщин состояние выявляется от 0,2 до 27% среди обследованных, в зависимости от региона и дополнительных заболеваний и состояний.
Причины и виды холестатического синдрома
Существует две основные формы патологии – внепеченочная и внутрипеченочная. Первая развивается в случае полной или частичной закупорки желчных протоков, чаще всего камнями при желчнокаменной болезни и холедохолитиазе, а также при опухоли органов гепатобилиарной системы, дисфункции сфинктера Одди, описторхоза, врожденных аномалий желчевыводящих путей.
Внутрипеченочный холестаз – следствие заболеваний гепатоцеллюлярной системы, таких как гепатиты вирусного, алкогольного и медикаментозного происхождения, жировая болезнь печени (довольно частая патология современного человека, поражающая до 20% людей и более, в зависимости от возраста и массы тела) и ее аутоиммунные поражения, дефекты внутрипеченочных протоков.
Среди частых причин патологии также врожденные метаболические нарушения (галактоземия, муковисцидоз и другие), саркоидоз, изменения гормонального фона, например, при беременности.
Проявления застоя желчи
Холестаз у беременных женщин и детей
Отдельного внимания заслуживают такие формы патологии, как холестаз во время вынашивания плода и в детском возрасте. В этих случаях механизм развития нарушений и симптомы имеют свои особенности.
Проявления холестаза у беременных наблюдаются в третьем триместре. Кожный зуд может быть ярко выраженным или практически не доставлять дискомфорта. Расчесы чаще отмечаются на руках, голенях, предплечьях. Желтуха встречается лишь у одной из десяти женщин и, как правило, проходит самостоятельно через две недели после родов. Однако при выраженной желтухе и раннем начале (до 25-27-й недели беременности) может повышать риск осложнений в родах.
Детский холестаз может наблюдаться как с первых месяцев жизни, так и появиться в более старшем возрасте. В младенчестве чаще встречаются внутрипеченочный холестатический синдром, вызванный врожденными метаболическими нарушениями, идиопатический неонатальный гепатит и пороки развития желчных протоков. Причинами холестаза могут быть также инфекции, токсические поражения органов, цирроз печени, сердечно-сосудистая недостаточность, опухоли поджелудочной железы, паразитарные поражения, склерозирующий холангит.
Опасность холестаза в том, что он развивается у детей в скрытой форме. Симптоматика зависит от возраста, в котором проявилось заболевание, и особенностей организма.
Диагностика патологии
Диагностику и лечение синдрома холестаза проводит врач-гастроэнтеролог. Некоторые пациенты ошибочно консультируются с дерматологом, акцентируя внимание только на кожном зуде и не принимая во внимание прочие симптомы.
Заподозрить патологию врачу позволяют беседа с больным, внешний осмотр кожи и слизистых пациента. Пальпация и перкуссия часто позволяют выявить увеличение печени в размерах, болезненные области. Нередко холестатический синдром протекает почти бессимптомно, и на его наличие указывают только лабораторные анализы. Они заключаются в определении уровня билирубина, холестерина, щелочной фосфатазы, ферментов и желчных кислот в крови, желчных пигментов в моче.
Для общего анализа крови при холестазе характерны анемия, лейкоцитоз, завышенные значения СОЭ. В биохимическом анализе крови выявляются гипербилирубинемия (за счет прямого (конъюгированного) билирубина), гиперлипидемия, повышение активности ферментов, таких как аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза (ЩФ), гаммаглутамилтранспептидаза (ГГТП). Обнаружение антимитохондриальных, антинуклеарных антител и антител к гладкомышечным клеткам позволяет заподозрить аутоиммунное поражение печени как возможную причину холестаза.
Инструментальная диагностика холестаза предполагает ультразвуковое и рентгеновское исследования органов брюшной полости, гастро- и дуоденоскопию, магнитно-резонансную или эндоскопическую ретроградную холангиопанкреатографию, чрескожную чреспеченочную холангиографию. Диагноз может быть установлен на любом этапе, даже просто после выполнения лабораторных анализов и УЗИ, не все вышеперечисленные исследования обязательно потребуются для диагностики.
Если результаты проведенных обследований сомнительны, то прибегают к биопсии печени (которая также может быть назначена на любом этапе диагностического поиска).
Лечение холестаза
Первая мера при выявлении холестаза или подозрении на него – коррекция питания. Особенностью такой диеты является замена животных жиров на растительные. Рекомендуется употреблять больше овощей и фруктов, выбирать нежирные сорта мяса и виды молочных продуктов. Полезны также каши на основе злаковых культур. Нужно ограничить жареные, копченые и острые продукты. Следует полностью отказаться от спиртного, крепкого кофе и чая.
Лечение беременных осложняется рисками для плода при применении лекарств, потому для уменьшения симптоматики прибегают в первую очередь к простым и безопасным средствам – маски из овсяных хлопьев, отвар ромашки, использованию детского крема.
Холодная вода и сон в прохладном помещении облегчают кожный зуд. Однако при его усилении врачом могут быть назначены препараты желчных кислот, разрешенные к применению у беременных (в частности – урсодезоксихолевая кислота). Эти препараты определены американской Food and Drug Administration (FDA) на основании проведенных клинических исследований. Препараты, по которым накоплено достаточно данных о применении их у беременных, отнесены данной организацией к соответствующей группе (категории действия на плод).
Для успешного лечения холестаза у детей важно своевременно установить причину данного синдрома. Часто одними лекарствами патологию у этой группы больных не вылечить, тогда проводят хирургическую операцию.
Что такое дилатация внепеченочных желчных протоков
В настоящее время все более весомое значение в решении сложных задач дифференциальной диагностики заболеваний панкреатобилиарной системы отводится эндоскопической ультрасонографии (ЭУС, EUS). С развитием медицинских технологий появилась перспектива внедрения в клиническую практику новых методик, выполняемых при эндоскопическом ультразвуковом исследовании, таких как контрастное усиление (CH-EUS). Указанная методика значительно расширит возможности дифференциальной диагностики заболеваний панкреатобилиарной системы. На сегодняшний день актуальной задачей является оценка диагностической точности и определение места контрастного усиления в диагностическом алгоритме обследования пациентов с заболеваниями поджелудочной железы.
Приводим клиническое наблюдение пациентки с образованием общего желчного протока, при котором использование CH-EUS определении тактики лечения.
Ключевые слова: эндоскопическая ультрасонография, контрастное усиление, образование общего желчного протока, тубулярно-ворсинчатая аденома.
Введение
В настоящее время все более весомое значение в диагностике заболеваний панкреатобилиарной системы (ПБС) отводится эндоскопической ультрасонографии. С развитием медицинских технологий появилась перспектива внедрения в клиническую практику новых методик, выполняемых при эндоскопическом ультразвуковом исследовании, таких как контрастное усиление. Указанная методика значительно расширяет возможности дифференциальной диагностики заболеваний ПБС [1, 2, 3].
По данным европейских и японских исследователей, эндоскопическая ультрасонография с контрастированием является принципиально новым методом эндосонографической диагностики, позволяющим произвести качественный и количественный анализ степени васкуляризации исследуемого объекта, что способствует объективной диагностике непосредственно во время эндоскопического ультразвукового исследования [4, 5, 6, 7].
Практическое использование контрастов для усиления эхо-сигнала началось в 1982 году в эхокардиографии [8]. В 1990 году появилось первое поколение ультразвуковых аппаратов с контрастным усилением для исследования брюшной полости [9]. Первые положительные результаты использования контраста при УЗИ печени дали начало активного применения этой технологии для других паренхиматозных органов [10].
Газовые пузырьки контрастного вещества первого поколения не были достаточно устойчивыми для непрерывного ультразвукового сканирования. В 2001–2002 гг. было введено в использование новое поколение контрастных веществ на основе высокоплотных газов (Sonovue и др.), которые не выходят за пределы кровеносного русла, а их распределение в организме полностью совпадает с распределением эритроцитов [11]. В последующем на основе биополимеров (Sonovist) были разработаны препараты третьего поколения, состоящие из заполненных газом микросфер, средний диаметр которых составляет 1 мкм. Оболочка микропузырька представляет собой тончайший слой саморазрушающегося полимера. Препарат стабилен в течение нескольких часов и избирательно накапливается в печени и селезенке.
Поскольку при обычной частоте ультразвуковой волны разрушение микропузырьков происходило очень быстро, производители ультразвуковой аппаратуры предусмотрели специальный режим получения изображений при низком механическом индексе (МИ) для использования контрастного вещества [12]. Этот режим позволил поддерживать колебания микропузырьков и визуализировать их в паренхиматозной ткани в режиме реального времени. Благодаря возможности непрерывного ультразвукового сканирования в период притока контрастного вещества и его распределения в тканях оценивается динамика контрастного усиления.
Первый опыт CH-EUS с использованием нового линейного прототипа эхоэндоскопа сообщили Kitano М. и соавт. [13]. Первоначально они проводили эксперименты на животных моделях, затем на двух пациентах, один из которых с раком поджелудочной железы, а другой с гастроинтестинальной стромальной опухолью. Исследователи сделали вывод о возможной роли CH-EUS при исследовании некоторых заболеваний пищеварительного тракта. Далее те же авторы продолжили исследование, чтобы оценить потенциал CH-EUS в клиническом применении [14]. В общей сложности были проанализированы результаты обследования 104 пациентов. После чего сделан вывод, что СН-EUS является перспективным неинвазивным методом для оценки перфузии и микроциркуляции исследуемого образования и играет важную роль в дифференциальной диагностике заболеваний панкреатобилиарной системы.
На данный момент в России в качестве контрастного препарата используется Sonovue, который был лицензирован в 2013 году, и с тех пор отечественные специалисты ультразвуковой диагностики и эндосонографии накапливают собственный опыт применения данного препарата при различных заболеваниях панреатобилиарной системы и желудочно-кишечного тракта. Sonovue содержит микропузырьки высокоплотного газа гексафторида серы, который является инертным веществом и не имеет фармакологического действия. Физический эффект состоит во взаимодействии микропузырьков и ультразвуковых волн, что приводят к появлению эхо-сигнала (контрастное усиление). Препарат не нарушает функцию щитовидной железы, не обладает нефротоксичностью и может применяться независимо от степени снижения функции почек пациента. Sonovue контрастирует исключительно сосуды и быстро выводится из системы кровообращения с выдыхаемым воздухом.
В Московском клиническом научном центре имени А. С. Логинова с 2016 года накапливается опыт использования контрастного усиления под контролем ЭУС. Данный метод применяется при неинформативности других методов исследования и при сложности постановки диагноза при проведении ЭУС.
В данной статье приводится пример использования контрастного усиления при проведении эндоскопической ультрасонографии в дифференциальной диагностике заболевания общего желчного протока.
Клинические наблюдения
Пациентка К., 70 лет
Поступила В МКНЦ с жалобами на желтуху, кожный зуд. Анамнез заболевания: считает себя больной с января 2017 года, когда отметила снижение веса на 22 кг за последние три месяца, пожелтение кожных покровов. Обратилась в поликлинику по месту жительства, обследована, выявлено повышение уровня билирубина до 40 мкмоль/л (прямой – 36,5). На УЗИ брюшной полости от 21.02.2017 г. – расширение внутри и внепеченочных желчных протоков, эхогенное содержимое в общем желчном протоке, увеличение размеров головки поджелудочной железы.
С клиникой механической желтухи пациентка была госпитализирована в отделение высокотехнологичной хирургии и хирургической эндоскопии Московского клинического научного центра имени А. С. Логинова для обследования и определения тактики лечения.
В биохимическом анализе крови отмечалось повышение уровня следующих показателей: АЛТ 40,8 Ед/л, АСТ 55,5 Ед/л, билирубин общий 158,0 мкмоль/л (прямой – 82,0 мкмоль/л, непрямой – 76,0 мкмоль/л), глюкоза 10,17 мкмоль/л, гамма-глутамилтрансфераза 159 Ед/л, щелочная фосфатаза 158,0 Ед/л. В иммунологическом исследовании отмечалось повышение CA 19–9 до 35,6 Ед/мл.
Ультразвуковое исследование органов брюшной полости: желчные протоки расширены в обеих долях (сегментарные до 4–6 мм, долевые до 10–11 мм), общий желчный проток расширен до 18 мм, в его терминальном отделе определяются гипоэхогенное неоднородные содержимое, на уровне головки поджелудочной железы – полностью обтурирующие ОЖП, неравномерно суживая внутренний его просвет на протяжении не менее 50 мм.
Заключение: билиарный сладж? Образование терминального отдела холедоха? Выраженная билиарная гипертензия.
Мультиспиральная компьютерная томография органов брюшной полости, в/в контрастирование: печень в размерах увеличена (256 х 124 х 185 мм), с ровными четкими контурами. Плотность паренхимы 40 ед.Н, на этом фоне сосудистый рисунок определяется. При нативном сканировании структура паренхимы печени гомогенная. При контрастировании – гипо- и гиперденсных образований не выявляется, сосудистая система прослеживается на всем протяжении. Ширина ствола воротной вены 13 мм. Элементы ворот печени дифференцированы.
Внутри- и внепеченочные желчные протоки расширены: сегментарные до 4 мм, общий печеночный проток до 16 мм. Определяется образование общего желчного протока на уровне панкреатического/ретродуоденального отдела до впадения пузырного протока в виде внутрипросветной изоденсной структуры протяженностью до 25 мм и общей толщиной до 20 мм. Плотность образования 34–40 ед Н, накапливает препарат в АФ до 52 ед. Н, в ВФ до 67 ед. Н, в ОФ 53 ед. Н. По переднему контуру образования холедоха проходит правая долевая печеночная артерия. Ширина общего желчного протока в дистальном отделе до 9 мм. Лимфоузлы: по ходу гепатодуоденальной связки до 10 х 24 мм, парааортальные и аортокавальные до 5 мм. Определяется парафатеральный дивертикул диаметром 9 мм, содержимое дивертикула – газ.
Заключение: КТ картина образования средней-нижней трети общего желчного протока (c-r? сладж?) с расширением внутри- и внепеченочных билиарных протоков. Регионарная лимфаденопатия. Парафатеральный дивертикул.
Эндоскопическая ультрасонография с контрастным усилением: внутрипеченочные желчные протоки немного расширены. Гепатикохоледох в проксимальном отделе до 18 мм, стенки немного утолщены, в просвете гиперэхогенная взвесь. От уровня пузырного протока стенки общего желчного протока ассиметрично утолщены за счет папиллярных разрастаний внутрипротоково стелящейся опухоли и наличия неоднородного содержимого (рис. 1). В режиме ЦДК определяются сигналы. Преампулярная и интраампулярная части протока имеет анэхогенный просвет, стенки немного утолщены.
БДС округлой формы, средней эхогенности, размерами до 10 мм, в проекции БДС диаметр ОЖП до 1,5 мм, ГПП – до 1,0 мм. Парапапиллярно определяется дивертикул до 1,0 см. По ходу гепатодуоденальной связки лимфатический узел до 14х11мм.
Поджелудочная железа: эхогенность паренхимы понижена, структура неоднородная. ГПП в головке до 3,0 мм, в теле 2,0 мм, ход прямой, просвет свободный.
Для верификации кистозного содержимого необходимо проведение контрастного усиления. При введении Sonovue в раннюю фазу (10–30 с после в/в инъекции) отмечалось активное накопление контраста образованием (гиперусиление), которое сохранялось и позднюю фазу (31–180 с после в/в инъекции) с последующим медленным вымыванием контрастного вещества (рис. 2). Накопление контраста было усиленное и равномерное, что характерно для доброкачественного характера образования.
Заключение: сонографические признаки «стелящейся опухоли» общего желчного протока (внутрипротоковая папиллярная неоплазия желчного протока?). Парафатериальный дивертикул. Увеличение лимфатических узлов по ходу гепатодуоденальной связки. Диффузные изменения поджелудочной железы
Магнитно-резонансная холангиография: внутрипеченочные желчные протоки умеренно расширены, долевые до 6 мм, не дифференцируются. Конфлюенс обычного типа. Гепатикохоледох до 15 мм, в просвете его имеются множественные пристеночные структуры с признаками ограничения диффузии. Желчный пузырь сокращен.
Заключение: образование общего желчного протока? Лимфаденопатия лимфатических узлов гепатодуоденальной связки.
На основании полученных данных пациентке поставлен диагноз: «опухоль общего желчного протока, TXNXM0». Принято решение выполнить оперативное вмешательство в объеме лапароскопической резекции внепеченочных желчных протоков и формирование билиодигестивного соустья по Ру.
Оперативное вмешательство: лапароскопическая резекция внепеченочных желчных протоков; формирование билиодигестивного соустья по Ру; дренирование брюшной полости (интраоперационно: с помощью УЗ-скальпеля произведена мобилизация общего печеночного и общего желчного протока, желчного пузыря «от дна»). При инструментальной пальпации выявлено мягкотканое образование холедоха, распространяющееся на ретродуоденальную часть. Произведена мобилизация холедоха дистально до неизмененных тканей протока. О перевязан нитью пролен 1–0, отсечен холодными ножницами. Из просвета поступает слизеобразное содержимое. Тотчас выше впадения пузырного протока пересечен общий печеночный проток. Препарат извлечен (рис. 3).
Гистологическое исследование операционного материала: стенка общего желчного протока представлена грубоволокнистой соединительной тканью, определяется рост тубулярных и ворсинчатых структур с полной кишечной метаплазией, инвазии в мышечный слой стенки не наблюдается, строма отечная (рис. 4). В дистальном крае резекции элементов опухолевого роста не обнаружено.
Заключение: морфологическая картина соответствует тубуло-ворсинчатой аденоме общего желчного протока.
Заключение
Внутрипротоковая папиллярная неоплазия желчного протока (Intraductal papillary neoplasm of the bile duct – IPNB) является редко встречающейся опухолью, которая недавно была классифицирована как отдельная группа заболеваний [15]. IPNB, согласно классификации, включает аденому, карциному in-situ и инвазивную карциному. Опухоль может развиваться в любой части желчных протоков и, как правило, характеризуется экзофитным ростом [16]. В большинстве случаев IPNB наблюдается расширение желчных протоков и в трети случаев сопровождается повышенным муцинобразованием, что может вызвать холангит или обструктивную желтуху [17]. IPNB является эквивалентом сходной патологии панкреатических протоков – внутрипротоковой папиллярной муцинозной неоплазии поджелудочной железы (intraductal papillary mucinous neoplasm of the pancreas – IPMN-P) [4].
Таким образом, учитывая наличие роста в стенке слизистой общего желчного протока тубулярных и ворсинчатых структур без обнаружения атипии, данное образование было расценено как тубуло-ворсинчатая аденома общего желчного протока.
В представленном клиническом примере контрастное усиление под контролем эндосонографии позволило подтвердить тканевую структуру выявленного образования, предположить его доброкачественность и принять решение о виде оперативного вмешательства с целью устранения выраженной билиарной гипертензии.
Литература
Seicean A., Mosteanu O., Seicean R. Maximizing the endosonography: The role of contrast harmonics, elastography and confocal endomicroscopy. // World journal of gastroenterology. – 2017. – Jan 7. – №23 (1). – Р. 25–41.
Alvarez-Sánchez M. V., Napoléon B. Contrast-enhanced harmonic endoscopic ultrasound imaging basic principles, present situation and future perspectives. // World journal of gastroenterology. – 2014. – November. – №14; 20 (42): 15549–15563.
Napoleon B., Alvarez-Sanchez M. V., Gincoul R., Pujol B., Lefort C., Lepilliez V., Labadie M., Souquet J. C., Queneau P. E., Scoazec J. Y., Chayvialle J. A., Ponchon T. Contrast-enhanced harmonic endoscopic ultrasound in solid lesions of the pancreas: results of a pilot study. // Endoscopy. – 2010. – Jul. – №42 (7): 564–70.
Figueiredo F. A., da Silva P. M., Monges G., Bories E., Pesenti C., Caillol F., Delpero J. R., Giovannini M. Yield of Contrast-Enhanced Power Doppler Endoscopic Ultrasonography and Strain Ratio Obtained by EUS-Elastography in the Diagnosis of Focal Pancreatic Solid Lesions. // Endoscopic ultrasound. – 2012. – Oct. – №1 (3): 143–9.
Kitano M., Kamata K., Imai H., Miyata T., Yasukawa S., Yanagisawa A., Kudo M. Contrast-enhanced harmonic endoscopic ultrasonography for pancreatobiliary diseases. // Digestive Endoscopy. – 2015. – Apr. – № 27. Suppl 1:60–7.
Săftoiu A., Vilmann P., Dietrich C. F., Iglesias-Garcia J., Hocke M., Seicean A., Ignee A., Hassan H., Streba C. T., Ioncică A. M., Gheonea D. I., Ciurea T. Quantitative contrast-enhanced harmonic EUS in differential diagnosis of focal pancreatic masses. // Gastrointestinal Endoscopy. – 2015. – Jul. – №82 (1). – Р. 59–69.
Gincul R., Palazzo M., Pujol B., Tubach F., Palazzo L., Lefort C., Fumex F., Lombard A., Ribeiro D., Fabre M., Hervieu V., Labadie M., Ponchon T., Napoléon B. Contrast-harmonic endoscopic ultrasound for the diagnosis of pancreatic adenocarcinoma: a prospective multicenter trial. // Endoscopy. – 2014. – May. – №46 (5): 373–9.
Armstrong W. F., Mueller T. M., Kinney E. L. Assessment of myocardial perfusion abnormalities with contrast-enhanced two-dimensional echocardiography. // Circulation. – 1982. – №66 (1): 166–17.
Fritzsch T., Hilmann J., Kämpfe M., Müller N., Schöbel C., Siegert J. SH U 508, a transpulmonary echocontrast agent. // Investigative Radiology. – 1990. – №25 (1). – Р. 160–161.
Angeli E., Carpanelli R., Crespi G., Zanello A., Sironi S., Del Maschio A. Efficacy of SH U 508 A (Levovist) in color Doppler ultrasonography of hepatocellular carcinoma vascularization. // Radiologia Medica. – 1994. – №87 (5, supplement 1): 24–31.
Arditi M., Brenier T., Schneider M. Preliminary study in differential contrast echography. // Ultrasound in Medicine and Biology. – 1997. – №23 (8). – Р. 1185–1194.
Bauer A., Solbiati L., Weissman N. Ultrasound imaging with SonoVue: low mechanical index real-time imaging. // Academic Radiology. – 2002. – №9 (2). – Р. 282–284.
Kitano M., Kudo M., Sakamoto H., Nakatani T., Maekawa K., Mizuguchi N., Ito Y., Miki M., Matsui U., von Schrenk T. Preliminary study of contrast-enhanced harmonic endosonography with second generation contrast agents. // Journal of Medical Ultrasonics. – 2008. – №35. – Р. 11–18.
Kitano M., Sakamoto H., Matsui U., Ito Y., Maekawa K., von Schrenck T., Kudo M. A novel perfusion imaging technique of the pancreas: contrast-enhanced harmonic EUS. // Gastrointestinal Endoscopy. – 2008. – Jan. – №67 (1): 141–50.
Zen Y., Fujii T., Itatsu K., Nakamura K., Minato H., Kasashima S. Biliary papillary tumors share pathological features with intraductal papillary mucinous neoplasm of the pancreas. // Hepatology (Baltimore, Md). – 2006. – №44 (november (5)). – Р. 1333–1343.
Paik K. Y., Heo J. S., Choi S. H., Choi D. W. Intraductal papillary neoplasm of the bile ducts: the clinical features and surgical outcome of 25 cases. // J. Surg. Oncol. – 2008. – №97 (may (6)). – Р. 508–512.
Kubota K., Nakanuma Y., Kondo F., Hachiya H., Miyazaki M., Nagino M. Clinicopathological features and prognosis of mucin-producing bile duct tumor and mucinous cystic tumor of the liver: a multi-institutional study by the Japan Biliary Association. // J. Hepato-Biliary-Pancreatic Sci. – 2014. – №21 (march (3)). – Р. 176–185.
Gordon-Weeks A. N., Jones K., Harriss E., Smith A., Silva M. Systematic review and meta-analysis of Current Experience in Treating IPNB: clinical and pathological correlates. // Ann. Surg. – 2016. – №263 (аpril (4)). – Р. 656–663.
