что такое дхлж по узи сердца у взрослого
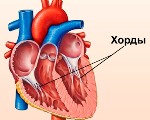
Дополнительная хорда сердца у ребенка
Дополнительная хорда сердца у ребенка — это малая аномалия развития, которая представляет собой тяж, расположенный внутри желудочка. Возникает из-за наследственной или впервые возникшей генетической мутации, нарушающей дифференцировку кардиальных тканей во внутриутробном периоде. Протекает бессимптомно либо проявляется кардиалгиями, перебоями в работе сердца, повышенной утомляемостью. План диагностических мероприятий включает ЭхоКГ, ЭКГ, постановку функциональных нагрузочных тестов. Лечение бессимптомных хорд не проводится, при развитии осложнений назначают патогенетические препараты, иногда требуется помощь детских кардиохирургов.
МКБ-10
Общие сведения
Впервые патология была описана в 1893 г. и носила название «мышечный тяж». Современный термин появился позднее благодаря расположению образования, фактически пересекающего полость желудочка. По данным эхокардиографии, частота обнаружения хорд колеблется от 0,5% до 68% в популяции, что обусловлено отсутствием единых критериев диагностики. У мальчиков аномалия встречается в 2-3 раза чаще. Поскольку формирование дополнительной хорды у детей происходит во время внутриутробного развития, тяжи могут выявляться в любом возрасте. Пики заболеваемости отсутствуют.
Причины
Аномальные тяжи являются одной из разновидностей дисплазии соединительной ткани сердца (ДСТС), поэтому четкие этиологические факторы их появления не установлены. В современной педиатрии считается, что возникновение малых аномалий связано с действием неблагоприятных факторов в раннем внутриутробном периоде развития плода. Среди основных причин патологии можно выделить следующие:
Патогенез
Основная теория заключается в том, что образование дополнительной мышечной трабекулы происходит в процессе эмбрионального развития ребенка. Тяжи формируются из внутреннего слоя миокарда при отшнуровке сосочковых мышц. При нарушении дифференцировки клеток часть из них идет на создание папиллярных структур, а оставшиеся клетки организуются в добавочные хорды и располагаются внутри полости желудочка.
Морфологические изменения при дисплазии характеризуются изменениями структуры коллагеновых и эластиновых волокон, нарушением нормального соотношения гликопротеидов, протеогликанов и фибробластов. При этом наблюдается патология пространственной организации белков и белково-углеводных комплексов. Ряд авторов отводят важную роль гипомагниемии в патогенезе хорд и вызываемых ими симптомов.
Классификация
Выделение вариантов внутрисердечных хорд — дискутабельный научный вопрос, поскольку на сегодняшний день существует несколько классификаций. Гистологические исследования секционного материала дают возможность разделить тяжи в сердце на 3 вида:
Среди фиброзно-мышечных до 4,7% составляют образования, которые содержат проводящие кардиомиоциты.
А.А. Корженков предложил разделить хорды на 5 вариантов по локализации. Самые частые из них: поперечные (до 60% случаев) и диагональные (30-35%). К редким разновидностям внутрисердечных тяжей относят продольные (2-3%), множественные (1-2%), с тремя и более точками прикрепления (до 1%). Дополнения классификации включают определение длины и толщины образования, его расположения относительно основных анатомических ориентиров.
Симптомы
Для добавочных хорд сердца у детей характерна вариабельность течения: от бессимптомных вариантов, выявляющихся при инструментальной диагностике по другому поводу, до явных признаков нарушений сердечной деятельности и общего состояния. По наблюдениям врачей, малые аномалии являются основной причиной наличия функциональных сердечных шумов, которые хотя бы раз в жизни диагностируются у каждого второго-третьего ребенка.
Около 50% больных с дополнительными хордами иногда испытывают боли в сердце. Ребенок жалуется на покалывание, ноющие или давящие ощущения, которые не имеют четкой связи с физическими или эмоциональными нагрузками. Примерно с такой же частотой возникают аритмии, которые ощущаются как сильное сердцебиение или, наоборот, замирание сердца на несколько секунд, что сопровождается ухудшением самочувствия.
У многих детей наблюдается плохая переносимость физических нагрузок, утомляемость после коротких спортивных занятий в школе. При интенсивных тренировках возможны обмороки, длительное усиленное сердцебиение, повышенный прилив крови и жара к голове. Иногда ребенок ощущает нехватку воздуха, вследствие чего он начинает делать быстрые и глубокие вдохи. Среди атипичных эквивалентов одышки называют частую зевоту, покашливание, першение в горле.
Поскольку ДСТС обычно комбинируется с другими стигмами дизэмбриогенеза, у ребенка могут быть нарушения формы черепа и лица, неправильный разрез глаз, асимметрия туловища и конечностей. Изредка добавочные хорды выступают одним из проявлений синдрома Марфана: в таком случае ребенок имеет характерное астеническое телосложение, обвисшую истонченную кожу и другие патогномоничные симптомы.
Осложнения
Дополнительные хорды в 73% случаев ассоциированы с синдромом ранней реполяризации желудочков, что повышает риск развития пароксизмальной наджелудочковой тахикардии. При наличии ДСТС в 4-6 раз чаще встречается феномен предвозбуждения желудочков (Вольфа-Паркинсона-Уайта), который провоцирует тяжелые аритмии. Прослеживается четкая закономерность: чем ближе к базальной части межжелудочковой перегородки расположен тяж, тем выше его аритмогенность.
Ребенка с дополнительной хордой в сердце намного чаще беспокоят синкопальные состояния, обусловленные пароксизмами нарушений сердечного ритма и расстройствами регуляции сосудистого тонуса. У 30% обнаруживают геморрагический синдром, который развивается на фоне мезенхимальной дисплазии. Он проявляется кровоточивостью десен, частыми носовыми кровотечениями, у девочек-подростков дополнительной жалобой становятся длительные и обильные менструации.
Диагностика
При стандартном клиническом обследовании у детского кардиолога обнаруживаются неспецифические признаки кардиопатологии. Пальпация и перкуссия не дают ценных сведений, а при аускультации врач зачастую выявляет у ребенка функциональные систолические шумы. Для визуализации малых аномалий и детальной оценки сердечной деятельности эффективны следующие диагностические методы:
Лечение дополнительной хорды сердца у ребенка
Если дополнительная хорда не сопровождается нарушениями работы сердца, в детской кардиологии придерживаются выжидательной тактики, периодически проводят повторные обследования. Большинству пациентов с дополнительной сердечной хордой не требуется специальное лечение. Наличие кардиалгий, аритмий и других симптомов — показание к назначению патогенетической и симптоматической терапии. При комбинированных дисплазиях сердечной ткани требуется консультация кардиохирурга.
Прогноз и профилактика
В большинстве случаев хорды существуют бессимптомно или малосимптомно, не влияют на повседневную жизнь пациента. Прогноз благоприятный, если у ребенка отсутствуют другие дисплазии или пороки сердца. При наследственных или мультифакторных нарушениях соединительной ткани прогноз ухудшается. Учитывая неясность этиопатогенетических особенностей ДСТС, меры профилактики не разработаны.
Дополнительная хорда левого желудочка
В основном у деток до совершеннолетия специалисты выявляют в сердечной деятельности небольшие нитеобразные соединительные ткани в области левого желудочка, что именуют как хорда. Узнав о данном отклонении в работе сердца своего ребенка, родители начинают паниковать. Однако в данных действиях нет никакого смысла, что недуг выявляется как дополнительная хорда и не является смертельной патологией. Но всё же при становлении данного процесса существует и другая сторона более опасная.
В связи с чем происходит становление и развитие хорд левого желудочка?
В основном возникновения дополнительной хорды связывают с наследственной склонностью к патологии. Зачастую передача осуществляется через мать, и менее реже через отца. С учетом этого, если же мама малыша знает о наличии аномалии у себя, необходимо обследовать и ребенка. Ведь о том, что у малыша также присутствует данное отклонение родители, могут и не знать, в силу отсутствия каких-либо настораживающих признаков.
Какие симптомы могут говорить о наличии дополнительной хорды у ребенка?
За помощью к высококвалифицированному специалисту пятигорскую поликлинику для взрослых и детей 4д, необходимо обратиться при наличии:
Вышеперечисленная симптоматика возникает в период взросления ребенка и остается по его окончанию.
Диагностические меры, направленные на выявление патологического процесса
Исследование необходимо для определения максимально точного диагноза, выявления специфических особенностей течения данной аномалии. Для этого специалисты нашего центра назначают проведение уз-диагностики, при помощи которой опытный врач имеет возможность оперативно выявить сердечную патологию. Помимо этого, проведение процедуры эхокардиографии дает сведения о положении сердца в данную минуту в действии. Диагностируют недуг при помощи метода Доплера. Он способствует выявлению длины нити, ее толщины, участка крепления, а также определению с какой скорость по ней осуществляется кровоток.
Методы борьбы и профилактики хорда левого желудочка
Данная аномалия не устраняется традиционным аптечным средством. Самые верные действия при выявлении — это поддерживание правильного режима питания и исключения занятий определенными видами спорта, а именно: подводное плавание, парашютизм, гимнастика, некоторые виды танцев.
После выявления дополнительной хорды специалисты пятигорской поликлиники для взрослых и детей 4D, назначают клиентам посещение индивидуальной или групповой лечебной физкультуры, в которой содержится комплекс необходимых упражнений.
Помимо этого, пациентам советуют придерживаться режима дня, правильного питания, исключить возможную стрессовую ситуацию, посещать массажные процедуры и ежегодно осуществлять проведение диагностики.
Клиническое значение малых аномалий развития сердца у детей
В последние годы большое внимание уделяется дисплазии соединительной ткани (ДСТ) у детей. Под ДСТ понимают врожденную аномалию соединительно-тканной структуры различных органов и систем, в основе которой лежит снижение содержания отдельных
В последние годы большое внимание уделяется дисплазии соединительной ткани (ДСТ) у детей. Под ДСТ понимают врожденную аномалию соединительно-тканной структуры различных органов и систем, в основе которой лежит снижение содержания отдельных видов коллагена и/или нарушение их соотношения, приводящее к снижению прочности соединительной ткани [12, 13, 24, 26].
В развитии ДСТ принимают участие эндогенные (хромосомные и генетические дефекты) и экзогенные (неблагоприятная экологическая обстановка, неадекватное питание, стрессы) факторы [12, 30, 43]. Особенность морфогенеза соединительной ткани заключается в том, что она участвует в формировании каркаса сердца практически на всех этапах онтогенеза, следовательно, влияние любого повреждающего фактора может привести к развитию ДСТ сердца [15].
В 1990 г. в классификации заболеваний сердечно-сосудистой системы Нью-Йоркской ассоциации кардиологов, а также в Омске, на симпозиуме, посвященном проблеме дисплазии соединительной ткани, был впервые выделен синдром ДСТ сердца, сопровождающий как дифференцированные, так и недифференцированные ДСТ. При синдроме ДСТ сердца в патологический процесс вовлекается его соединительно-тканный каркас — сердечные клапаны (атриовентрикулярные, полулунные, евстахиев клапан), подклапанный аппарат, перегородки сердца и магистральные сосуды.
В клинической практике, когда речь идет о морфологической основе изменений сердечно-сосудистой системы без гемодинамических нарушений, Ю. М. Белозеровым (1993) и С. Ф. Гнусаевым (1995) вместо термина «ДСТ сердца» был предложен другой — «малые аномалии развития сердца» (МАРС) [3, 8]. Согласно определению этих авторов, МАРС считаются анатомические изменения архитектоники сердца и магистральных сосудов, не приводящие к грубым нарушениям функций сердечно-сосудистой системы [9].
Классификация МАРС по С. Ф. Гнусаеву, 2001 (с изменениями)
предсердия и межпредсердная перегородка: пролабирующий клапан нижней полой вены, увеличенный евстахиев клапан более 1 см, открытое овальное окно, небольшая аневризма межпредсердной перегородки, пролабирующие гребенчатые мышцы в правом предсердии;
трикуспидальный клапан: смещение септальной створки в полость правого желудочка в пределах 10 мм, дилатация правого атриовентрикулярного отверстия, пролапс трикуспидального клапана;
легочная артерия: дилатация ствола легочной артерии, пролапс створок;
аорта: погранично узкий и широкий корень аорты, дилатация синуса Вальсальвы, двустворчатый клапан аорты, асимметрия и пролапс створок клапана аорты;
левый желудочек: трабекулы (поперечная, продольная, диагональная), небольшая аневризма межжелудочковой перегородки;
митральный клапан: пролапс митрального клапана, эктопическое крепление хорд, нарушенное распределение хорд передней и (или) задней створки, «порхающие» хорды, дополнительные и аномально расположенные папиллярные мышцы.
До сих пор нет единого мнения о клиническом значении МАРС, многие из которых имеют нестабильный характер, связанный с ростом ребенка. Так, возможно обратное развитие увеличенного евстахиева клапана, пролабирующих гребенчатых мышц в правом предсердии, пролапса митрального клапана (ПМК), закрытие открытого овального окна, нормализация длины хорд митрального клапана и диаметра магистральных сосудов. В ряде случаев МАРС изменяются не только в качественном, но и в количественном отношении [3]. Превышение установленного порогового уровня сердечной стигматизации у здоровых детей (более 3 МАРС), по мнению С. Ф. Гнусаева (1995), свидетельствует о возможном неблагополучии как в отношении факторов, влияющих на формирование здоровья, так и показателей, характеризующих его [8].
Учитывая, что МАРС являются вариантом висцеральных ДСТ, дети, как правило, имеют выраженный полиморфизм клинико-морфологических нарушений, зависящий от степени ДСТ и вовлечения в патологический процесс других органов и систем. Выявлена ассоциативная связь между числом внешних фенотипических маркеров ДСТ и МАРС [12, 16, 21, 22]. При этом имеют значение не только число внешних фенотипических маркеров, но и «диагностический вес» каждого из них. Отмечено, что дисплазии кожи и скелета наиболее часто сочетаются с МАРС [12].
Клиническая значимость патологии соединительной ткани у лиц с ДСТ подтверждается данными о высокой частоте нейровегетативных расстройств, изменений центральной нервной системы (энурез, дефекты речи, вегетососудистая дистония (ВСД)), нарушений психики [5, 12, 24]. Как правило, у таких пациентов всегда выявляется ВСД, что, вероятно, обусловлено наследуемыми (наследственными) особенностями структуры и функции лимбико-ретикулярного комплекса, определяющими аномальный характер нейровегетативных реакций [12]. Е. В. Буланкиной (2002) установлена отчетливая взаимосвязь между вегетативной дисфункцией и ДСТ [4]. При этом выраженность диспластических изменений сочеталась с тяжестью процессов дезадаптации регуляторных механизмов и снижением стрессовой устойчивости организма. Наиболее распространенными проявлениями вегетативной дисфункции являются цефалгии, вегетативные кризы, вегетовисцеральные пароксизмы, пре- и синкопальные состояния [12, 16]. Согласно данным С. Ф. Гнусаева (1995), у лиц с ПМК выявлена недостаточность сегментарных вегетативных структур [8]. Исследования Т. М. Домницкой (2000) позволили установить прямую зависимость между ПМК, аномально расположенными трабекулами (АРТ) и распространенностью невротических (невротические реакции, невроз навязчивых состояний, панические расстройства) и энцефалопатических (церебрастенический синдром, заикание, тики, нарушения сна, энурез, гипердинамический синдром, страхи) расстройств [10].
Нередко МАРС сопровождают такие патологические состояния, как нарушения сердечного ритма и проводимости, в том числе синдром ранней реполяризации, синдром слабости синусового узла, синдром Вольф–Паркинсон–Уайта, повышение электрической активности левого желудочка, блокада правой ножки пучка Гиса, экстрасистолия и пароксизмальная тахикардия [4, 6, 8, 34]. По данным Л. А. Балыковой и соавт. (2002), у 90% больных с нарушениями сердечного ритма с помощью эхографии были выявлены МАРС (преимущественно ПМК) [2]. Однако не все МАРС сопровождаются нарушениями сердечного ритма и (или) могут являться их причиной. К аритмогенным МАРС относятся фиброзно-мышечные аномально расположенные хорды (АРХ) и АРТ, ПМК и пролапс трикуспидального клапана (ПТК), аневризма межпредсердной перегородки, увеличенный и/или пролабирующий евстахиев клапан.
Наличие проводящих кардиомиоцитов в фиброзно-мышечных АРХ и АРТ формирует дополнительные проводящие пути, чем объясняется происхождение импульса, опережающего внутрижелудочковое проведение и вызывающего раннее возбуждение прилежащих к нему сегментов с последующей их более ранней реполяризацией [12, 15, 19, 20, 28]. Имеется гистологическое подтверждение наличия проводящих клеток в АРТ с диагонально-базальной, срединно-поперечной и продольной локализацией и в АРХ, соединяющих базальные септальные отделы и боковую стенку левого желудочка [3, 10, 33]. M. Suwa и соавт. (1986) отметили возрастание частоты желудочковых экстрасистол с увеличением толщины хорды. По мнению E. Chesler и соавт. (1983), появление желудочковых экстрасистол связано с миксоматозно измененными хордами, вызывающими механическое раздражение стенки левого желудочка [27]. Факт аритмогенности АРХ и АРТ также подтверждается исчезновением у пациентов экстрасистолии в случае их самостоятельного разрыва или оперативного рассечения либо при физической нагрузке, когда уменьшается степень их натяжения [8, 10, 12]. Довольно распространенным нарушением сердечного ритма при АРХ и АРТ является и синдром раннего возбуждения желудочков [6, 12].
Аритмии при ПМК и ПТК, по данным разных авторов, встречаются от 15 до 90% случаев [11]. Среди причин аритмий рассматриваются вегетативные дисфункции, механическая стимуляция эндокарда, дефицит внутритканевого магния, психологический стресс и миксоматозная дегенерация створок клапанов [3, 10–12, 18, 27, 29, 37, 39]. Установлена прямая корреляционная зависимость между частотой, а также степенью тяжести нарушений ритма и глубиной ПМК [1]. Ряд авторов полагают, что причиной развития аритмий при ПМК и ПТК может являться турбулентный поток, возникающий в результате регургитации через клапанное кольцо во время систолы желудочков, особенно при ПТК, когда происходит механическое раздражение зоны синусового узла [3, 8, 23]. Возможным механизмом развития желудочковых экстрасистол при ПМК большинство исследователей считают избыточное натяжение папиллярных мышц вследствие их аномальной тракции при пролабировании створок [12, 14, 25, 38].
Развитие аритмий может провоцировать пролабирующий евстахиев клапан и аневризма межпредсердной перегородки: условия для возникновения аритмий возникают в результате их холмистых движений и рефлекторного раздражения ими пейсмекерных образований в правом предсердии [42].
Согласно исследованиям О. А. Дианова (1999), нарушения сердечного ритма встречались у детей с погранично узкой аортой, у которых в 32,4% случаев регистрировалась суправентрикулярная и в 10,8% — желудочковая экстрасистолии, свидетельствующие о декомпенсации адаптации, особенно в условиях физической нагрузки [4].
По данным Ю. М. Белозерова, дети с МАРС отличаются сниженными возможностями кардиогемодинамики и демонстрируют плохую переносимость физических нагрузок [3]. По данным Н. А. Мазура, установлена связь между ПМК и синдромом внезапной смерти у взрослых. Накоплено достаточно сведений о том, что дети с МАРС относятся к группе риска по развитию инфекционного эндокардита.
Таким образом, существующие результаты исследований о том, что МАРС в ряде случаев являются основой кардиоваскулярной патологии у детей. В то же время неоправданным было бы преувеличение их роли в функциональных нарушениях сердечно-сосудистой системы. Очевидно, в каждом конкретном случае значимость структурных аномалий сердца должна рассматриваться индивидуально.
Принципы терапии детей с МАРС еще до конца не сформулированы. Однако на сегодняшний день можно предложить следующую тактику ведения детей с МАРС:
Общепризнанным является применение немедикаментозных методов лечения, включающих:
Вопрос о допуске к занятиям спортом решается индивидуально. При наличии ПМК необходимо учитывать семейный анамнез (случаи внезапной смерти у родственников), наличие жалоб на сердцебиения, кардиалгии; синкопальные состояния; изменения на ЭКГ (нарушения сердечного ритма, синдром укороченного и удлиненного QT) являются основанием для принятия решения о противопоказании спортивных тренировок. Это касается и наличия АРХ, АРТ с синдромом раннего возбуждения желудочков, которые, являясь аритмогенными МАРС, могут спровоцировать нарушения сердечного ритма у спортсменов в условиях физического и психоэмоционального напряжения.
Медикаментозное лечение включает применение:
В настоящее время терапия препаратами магния при МАРС приближается к патогенетической. Это обусловлено тем, что магний входит в состав основного вещества соединительной ткани и необходим для правильного формирования волокон коллагена. В условиях магниевой недостаточности нарушается способность фибробластов продуцировать коллаген [29, 31]. Кроме того, магний оказывает мембраностабилизирующее действие, удерживает калий внутри клетки, препятствует симпатикотоническим влияниям, что делает возможным его применение для лечения нарушений сердечного ритма [40, 41].
В работах О. Б. Степуры (1999), О. Д. Остроумовой и соавт. (2004) имеются сведения о достоверном уменьшении степени ПМК, симптомов ВСД, количества желудочковых экстрасистол на фоне терапии препаратами магния [17, 18].
Целесообразным может быть признано назначение следующих препаратов:
Магнерота, содержащего соль магния и оротовую кислоту. Последняя не только усиливает реабсорбцию Mg в кишечнике, но и обладает самостоятельным метаболическим действием. Детям назначают по 500 мг магнерота (32,8 мг магния 3 раза в день в течение 1 нед, затем 250 мг 3 раза в день в течение последующих 5 нед. Принимается препарат за 1 ч до еды).
Магне В6. Выпускается в таблетках (48 мг магния или в растворе для приема внутрь (100 мг магния). Детям с массой тела более 10 кг (старше 1 года) — 5–10 мг/кг/сутки в 2–3 приема. Детям старше 12 лет — 3–4 табл. в сут, в 2–3 приема. Продолжительность курса 6–8 нед.
Калия оротата. Детям препарат назначают из расчета 10–20 мг/кг/сут в 2–3 приема за 1 ч до еды или через 4 ч после еды. Продолжительность курса — 1 мес.
Следует проводить повторные курсы терапии этими препаратами (3–4 раза в год).
Для улучшения клеточной энергетикии миокарда применяют препараты, обладающие комплексным влиянием на метаболические процессы в организме, а также являющиеся активными антиоксидантами и мембраностабилизаторами:
Кроме указанных препаратов для улучшения метаболических процессов в соединительной ткани, миокарде и в организме в целом показано применение:
Показаны повторные курсы лечения (до 3 раз в год).
При наличии ВСД проводится комплексная длительная терапия по восстановлению баланса между симпатическим и парасимпатическим отделами вегетативной нервной системы (дифференцированная фитотерапия, вегетотропные препараты, ноотропы, вазоактивные препараты — кавинтон, вазобрал, инстенон, циннаризин и др.).
Таким образом, все вышесказанное позволяет сделать вывод, что МАРС, являясь висцеральным проявлением дисплазии соединительной ткани, составляют морфологическую основу функциональных изменений сердечной деятельности и нейровегетативных расстройств. Выбор индивидуальной программы курсового лечения способствует улучшению обменных процессов в соединительной ткани и профилактирует возможные осложнения ДСТ у детей и подростков.
По вопросам литературы обращайтесь в редакцию.
Н. А. Коровина, доктор медицинских наук, профессор
А. А. Тарасова, кандидат медицинских наук, доцент
Т. М. Творогова, кандидат медицинских наук, доцент
Л. П. Гаврюшова, кандидат медицинских наук, доцент
М. С. Дзис
РМАПО, Москва
Аневризма левого желудочка сердца
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
В результате ткань истончается и растягивается, образуя выпячивание- аневризму. Чаще всего поражается левый желудочек в передней верхней части.
Аневризма левого желудочка сердца классифицируется по нескольким признакам:
1. По времени появления:
2. По форме проявления:
В практике более часто встречаются диффузные формы, реже диагностируют расслаивающуюся и грибовидную аневризмы.
Симптомы и причины появления
Основная причина появления аневризма — инфаркт миокарда. Так же появление истонченных, выпирающих участков ткани на сердце может быть спровоцировано такими причинами, как:
Симптоматически наличие аневризмы левого желудочка сердца определить невозможно, но поскольку она вызывает нарушения работы сердца то и, соответственно, вызывает общие признаки расстройства сердечной деятельности. Среди них:
Диагностировать аневризму желудочка сердца может врач-кардиолог. После осмотра пациента и получения результатов всех необходимых исследований, в том числе ЭКГ, УЗИ и МРТ. Своевременная диагностика поможет избежать тяжелейших осложнений, часто смертельных. Для определения плана лечения необходимо точно знать локализацию, структуру и размеры аневризмы.
Методы диагностики
Главные способы диагностирования аневризмы основаны на последовательном выявлении клинических и инструментальных признаков. Начинается обследование с опроса больного, сбора анамнеза, некоторых лабораторных исследований крови и мочи — эти данные позволяют обнаружить сопутствующие заболевания, наличие которые может повлиять на развитие аневризмы. Пациент также получает направление на ЭКГ, МРТ или УЗИ и другие исследования.
Традиционные методы диагностики и информация, которую они предоставляют:
Комплексное всестороннее обследование пациента позволяет получить полную картину деформации тканей желудочка, а значит, назначить точное и наиболее эффективное лечение. Помимо медикаментозной терапии, больным с выявленной аневризмой левого желудочка сердца может быть назначено хирургическое вмешательство. Обычно такое решение принимается лечащим врачом в случае, если размеры поврежденной ткани превышают 20% площади стенки.
Методы лечения
В связи с относительно благоприятным прогнозом при бессимптомных аневризмах левого желудочка (ЛЖ), показания к хирургическому лечению у таких пациентов относительны. Тем не менее, у пациентов, которым показана хирургическая реваскуляризация миокарда (АКШ), в некоторых случаях необходимо выполнять хирургическое восстановление правильной формы левого желудочка.
Хирургическое лечение абсолютно показано пациентам, у которых в результате инфаркта миокарда появилась дисфункция ЛЖ с участками акинезии и дискинезии его стенок и закономерным увеличением объема ЛЖ: > 80 мл / м 2 при сокращении и > 120 мл / м 2 в момент расслабления, а также при угрозе разрыва аневризмы и в случае тромбоэмболического синдрома при тромбированных аневризмах.
При правильном профессиональном подходе, внимательном изучении функции ЛЖ по данным ЭхоКГ, оценке формы и локализации аневризмы, фракции выброса сокращающейся (уцелевшей) части ЛЖ – операция по устранению левожелудочковой аневризмы является вполне оправданной, так как впоследствии снижается напряжение в стенке ЛЖ, мышечные волокна вновь направляются в правильную сторону, возрастает систолическая и улучшается диастолическая функция ЛЖ.
Относительные противопоказания: крайне высокий риск анестезии, отсутствие «живого» миокарда за пределами аневризмы, низкий сердечный индекс.
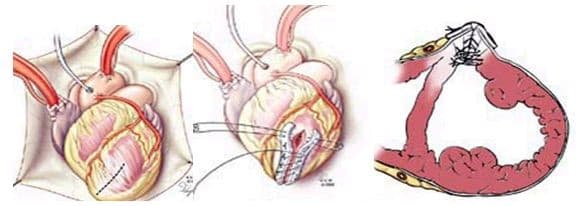
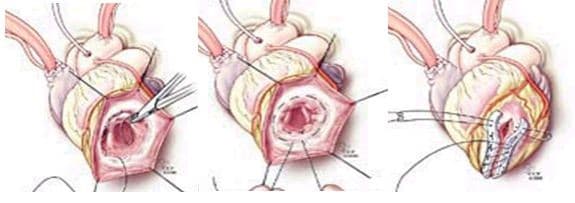
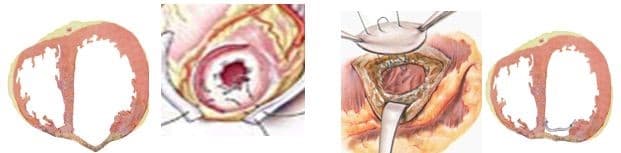
При хирургическом лечении аневризмы ЛЖ выполняется стандартный доступ путем срединной стернотомии. Аппарат искусственного кровообращения подключается как для АКШ, для удобства устанавливается дренаж ЛЖ через правые легочные вены. После кардиоплегии участок аневризмы выглядит как белесая, фиброзная площадка, впалая в полость левого желудочка. Выполняется разрез аневризмы вдоль передней нисходящей артерии, отступая от нее не менее 1,5 см. Имеющийся в полости тромб удаляется, исключая оставление даже очень мелких фрагментов. Часто такие операции сопровождаются вмешательством на митральном клапане, а также шунтированием передней нисходящей артерии и других артерий при наличии показаний. Оценив объем резецированного участка приступают к ремоделированию и восстановлению геометрии ЛЖ. Методик для этого предложено много, ниже мы приведем основные из них. После завершения хирургических манипуляций на сердце, выполняется важный процесс изгнания воздуха из полостей сердца, следом к сердцу пускают кровоток, снимая зажим с аорты, и через пару минут происходит восстановление сердечной деятельности. Окончание сеанса искусственного кровообращения для оперированного ЛЖ может стать настоящим испытанием и потребовать применение до трех инотропных и вазопрессорных препаратов, а также внутриаортальной баллонной контрапульсации.
Техники ремоделирования ЛЖ
Прогресс не стоит на месте, и методики постоянно совершенствуются, но основные хирургические принципы для лечения данной патологии представлены вашему вниманию и заключаются в стремлении к уменьшению полости ЛЖ за счет резекции нефункционального аневризматического мешка и восстановлению близкой к нормальной геометрической формы ЛЖ применяя разной формы заплаты и кисетные пластики.
Результаты хирургического лечения аневризмы левого желудочка сердца
Частым осложнением после операции по поводу аневризмы ЛЖ является синдром малого выброса, который развивается вследствие чрезмерного уменьшения размеров полости ЛЖ, а так же желудочковые нарушения ритма и легочная недостаточность.
30-ти дневная летальность в последние годы снизилась и составляет 3-7%. Факторы повышенного риска операции это: пожилой возраст, женский пол, операция в экстренном порядке, а так же операция дополненная протезированием митрального клапана, исходно низкая сократительная способность миокарда (ФВ менее 30%), умеренная и высокая легочная гипертензия, почечная недостаточность.
В нашей клинике успешно выполняются все виды операций на сердце включая хирургическое ремоделирование и пластику при аневризмах ЛЖ.