что такое денервационный процесс в мышцах
ДЕНЕРВАЦИЯ
ДЕНЕРВАЦИЯ (лат. приставка de- извлечение, уничтожение + nervus нерв) — разобщение связей какого-либо органа или ткани организма с нервной системой. Термин «денервация» чаще применяется в случаях разобщения эфферентной иннервации, но может обозначать и нарушение афферентной иннервации (см. Деафферентация).
В клинической практике Д. используется как метод лечения невритов и невралгий (напр., при некупирующейся невралгии тройничного нерва), каузалгии, фантомных болей, кишечных и бескаменных желчных колик, расстройств трофики (трофические язвы конечностей) и периферического кровообращения (ангионевроз, болезнь Рейно) и др. В физиол, исследованиях Д. используют для изучения зависимости каких-либо органов от влияния нервной системы и в целях раздельного изучения нервных и гуморальных влияний. Д. является одним из основных методов исследования эволюции функций. Применение этого метода, в частности, позволило Л. А. Орбели (1934) сформулировать положение об эволюции мышечной ткани, согласно к-рому мышца, лишенная моторной иннервации, возвращается к более примитивному состоянию, сходному с эмбриональным.
Д. достигается путем перерезки всех видимых нервных ветвей, применения различных хим. веществ (никотин, атропин, новокаин, этиловый спирт, фенол, декаметоний, тубокурарин и др.), физ. воздействий, нарушающих проведение возбуждения по нервным волокнам и в синапсах (напр., холодовый блок), использованием иммунологических методов и др.
В исследованиях, проведенных на гладких и скелетных мышцах, железах, сердце, нейронах вегетативных ганглиев, спинного и головного мозга различных животных было обнаружено, что через нек-рое время после Д. органы и ткани приобретают повышенную чувствительность к действию хим. веществ и поступающих нервных импульсов.
У. Кеннон сформулировал закон денервации (1935), позднее расширенный Розенблютом и Гарсией Рамосом (A. S. Rosenblueth, J. Garsia Ramos, 1945). По этому закону, если одно из звеньев функциональной цепи нейронов прервано, то общая или частичная Д. последующих звеньев в цепи приводит к повышению чувствительности всех дистальных элементов (включая и денервированные структуры и эффекторы); повышение чувствительности больше в звеньях, которые непосредственно примыкают к перерезанным нейронам, и меньше в более отдаленных элементах. Такое повышение чувствительности обусловлено многими механизмами. Так, после Д. мышечных волокон отмечается появление холинорецепторов на всей поверхности волокна; выявляются также изменения во взаимном расположении холинорецепторов. Д. сопровождается глубокими биохим, и структурными изменениями денервированного органа. Клинически Д. может проявляться в виде различных двигательных (параличи, контрактуры, гиперкинезы), трофических (трофические язвы, дистрофия, изменение потоотделения) и чувствительных нарушений. Одними из тяжелейших видов повышения и извращения чувствительности являются каузалгии и фантомные боли.
Г. Н. Сорохтиным и его сотр. (исследования в 1945—1973 гг.) показано, что в результате обратимой или необратимой Д. в различных органах и тканях, таких как скелетная мышца, слюнная железа, симпатический ганглий, дыхательный центр и другие, возникает особое состояние (так наз. дефицит возбуждения), связанное с прекращением поступления нервных импульсов. Оно характеризуется развитием состояния пассивной гиперполяризации и в зависимости от морфол, и функциональных особенностей структуры органов и тканей сопровождается повышенной или пониженной возбудимостью.
Библиография: Кеннон В. и Розенблют А. Повышение чувствительности денервированных структур, Закон денервации, пер. с англ., М., 1951; Михель-сонМ. Я. иЗеймаль Э. В. Ацетилхолин, о молекулярном механизме действия, Л., 1970, библиогр.; Орбели Л. А. Избранные труды, т. 1,с. 59, М.—Л., 1961; Сорохтин Г. Н. Реакция возбудимых систем на дефицит возбуждения, М., 1968; Физиология сенсорных систем, ч. 3, Физиология механорецепторов, под ред. О. Б. Ильинского, Л, 1975.
Что такое денервационный процесс в мышцах
а) Определения:
• Вторичное повреждение мышц, вызванное их денервацией вследствие повреждения нерва
1. Общие характеристики:
• Наиболее значимый диагностический признак:
о Диффузное усиление интенсивности сигнала в Т2, STIR при сохранении целостности мышечных волокон
• Размеры:
о Острая денервация: ± увеличение объема мышцы вследствие отека
о Хроническая денервация: атрофия мышцы
2. КТ при денервации мышц:
• При острой денервации мышцы выглядят нормально
• ± минимальное увеличение объема мышцы ± контрастное усиление (острая денервация)
• Снижение объема, гиподенсная жировая перестройка (хроническая денервация)
4. Другие методы исследования:
• Игольная электромиография (ЭМГ):
о Изменения электрической активности мышцы обычно появляются только через три недели после травмы иннервирующего ее нерва
5. Рекомендации по визуализации:
• Наиболее оптимальный метод диагностики:
о МРТ
• Протокол исследования:
о Плоскости сканирования необходимо выбирать таким образом, чтобы видеть поперечные сечения мышц
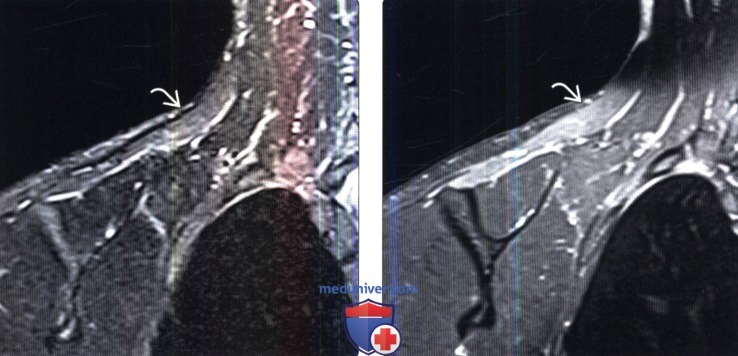
(Справа) На фронтальном FS Т1-ВИ с КУ у этого же пациента отмечается равномерное контрастное усиление пораженной мышцы. Разрывы мышцы в отличие от подобной картины характеризуются неоднородной картиной.
в) Дифференциальная диагностика денервации мышц:
1. Атрофия от неиспользования:
• Жировая атрофия мышцы
• Отек обычно отсутствует
2. Травма мышцы:
• Разрыв/нарушение целостности мышечных волокон
• Гематома обычно характеризуется неоднородностью сигнала в Т2, STIR
3. Разрыв сухожилия:
• Разрывы сухожилий мышц в конечном итоге также ведут к атрофии мышцы
4. Воспалительные изменения или инфекционное поражение мышцы:
• Патологические изменения Т2-сигнала и контрастное усиление выглядят более неравномерно
• Различные причины:
о Полимиозит/дерматомиозит
о Инфекционный миозит
о Диабетический мионекроз
о Рабдомиолиз
о Серповидноклеточный криз
5. Постлучевая миопатия:
• Васкулит, повреждение тканей → гомогенный отек мышцы
• Четкие границы отека, соответствующие области облучения
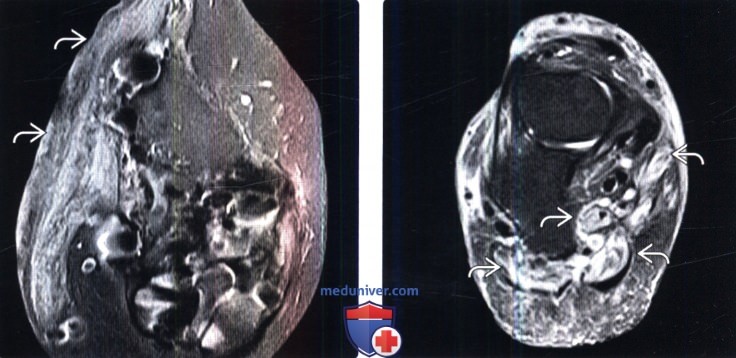
(Справа) Нa фронтальном FS Т2-ВИ определяются признаки денервационного отека собственных мышц стопы. Денервационный отек на фоне сахарного диабета характеризуется поражением в первую очередь мышц стопы. Мышцы в этой ситуации выглядят более исчерченными и менее гомогенными, чем при денервации другой этиологии.
г) Патология. Общие характеристики:
• Этиология:
о Опухоль нерва, инфекция, аутоиммунный неврит, периферическая нейропатия или травма
д) Клинические особенности:
1. Клиническая картина:
• Наиболее распространенные симптомы/признаки:
о Слабость, снижение объема мышц в зоне иннервации поврежденного нерва
о Может сопровождаться болевым синдромом
2. Течение заболевания и прогноз:
• При острой денервации в зависимости от тяжести повреждения нерва может наступать частичное или полное восстановление
• При хронической денервации изменения носят перманентный характер
3. Лечение денервации мышц:
• Лечение причин нарушения нервной проводимости, если это возможно
• Физиотерапия, направленная на укрепление сохранившихся мышечных групп
е) Диагностическая памятка. Советы по интерпретации изображений:
• Локализация изменений мышц напрямую говорит о локализации повреждения нерва
— Вернуться в оглавление раздела «Лучевая медицина»
Редактор: Искандер Милевски. Дата публикации: 10.9.2019
Что такое денервационный процесс в мышцах
При нарушении связи мышцы с иннервирующим ее нервом она больше не получает сигналов к сокращению, что необходимо для поддержания нормального размера мышцы. Следовательно, практически сразу начинается атрофия. Спустя примерно 2 мес дегенеративные изменения начинают проявляться в самих мышечных волокнах. При быстром восстановлении иннервации мышцы (в течение примерно 3 мес) возможно полное восстановление функции, но с этого времени способность к функциональному восстановлению постепенно снижается вплоть до невозможности какого-либо дальнейшего восстановления функции через 1-2 года.
В конечной стадии денервационной атрофии большинство мышечных волокон разрушаются и замещаются фиброзной и жировой тканью. Сохранившиеся волокна состоят из длинной клеточной мембраны мышечной клетки с различимыми ядрами, но со слабыми сократительными свойствами или полным их отсутствием. При восстановлении нервного снабжения эти волокна практически не способны к регенерации миофибрилл.
Фиброзная ткань, замещающая мышечные волокна во время денервационной атрофии, тоже проявляет тенденцию к дальнейшему укорочению в течение многих месяцев, что называют контрактурой. Следовательно, одна из наиболее важных проблем в практике физиотерапии состоит в удержании подвергающихся атрофии мышц от развития нарушающих работоспособность и обезображивающих контрактур. Это достигается ежедневным растягиванием мышц или использованием аппаратов, удерживающих мышцы в растянутом состоянии во время развития атрофии.
Восстановление сокращения мышц при полиомиелите: развитие макромоторных единиц. Если разрушается часть иннервирующих мышцу нервных волокон, как обычно бывает при полиомиелите, оставшиеся нервные волокна разветвляются, формируя новые аксоны, которые затем иннервируют многие из парализованных мышечных волокон. Это ведет к формированию крупных двигательных единиц, называемых макромоторными единицами. Число мышечных волокон в них может в 5 раз превышать нормальное количество волокон на каждый мотонейрон спинного мозга.
Это снижает точность управления больными мышцами, но позволяет им в некоторой степени восстановить силу.
Трупное окоченение. Через несколько часов после смерти все мышцы тела приходят в состояние контрактуры, называемой трупным окоченением, при котором мышцы сохраняют сокращенное состояние, становясь ригидными даже без потенциалов действия. Ригидность мышц возникает в результате потери АТФ, необходимого для отделения поперечных мостиков от актиновых нитей для осуществления расслабления. Мышцы остаются в состоянии окоченения до тех пор, пока (примерно через 15-25 ч) не распадутся мышечные белки, преимущественно в результате аутолиза (самопереваривания) под действием ферментов, выделяющихся из лизосом. Все эти процессы происходят быстрее в условиях повышенной температуры.
Электромиографические стадии денервационно-реиннервационного процесса при нервно-мышечных болезнях: необходимость ревизии
Полный текст:
Аннотация
Анализ параметров потенциалов двигательных единиц (ПДЕ), регистрируемых игольчатыми электродами, является ключом к пониманию изменений двигательных единиц при разных нервно-мышечных болезнях. Отечественная классификация изменений ПДЕ по стадиям денервационно-реиннервационного процесса (ЭМГС-ДРП) основана на анализе результатов обследования пациентов с миогенными, синаптическими, нейрогенными и нейрональными уровнями поражения. В статье обсуждаются причины появления типичных и атипичных ПДЕ малой длительности, сниженной и повышенной амплитуды, рассматриваются взаимно дополняемые результаты оценки мышечных биоптатов и данные нейрофизиологического анализа плотности мышечных волокон и макро-ЭМГ при первично-мышечных поражениях и патологии нервно-мышечной передачи. Отсутствие первично нейрогенных изменений, подтвержденное результатами анализа плотности мышечных волокон и макро-ЭМГ, при воспалительных и невос палительных болезнях мышц, патологии нервно-мышечной передачи делает невозможным использование ЭМГС-ДРП для оценки данных уровней поражения. Концепция ЭМГС-ДРП может быть использована лишь при невритическом и нейрональном уровнях поражения, позволяя оценивать изменение объема компенсаторной иннервации, но при этом не отражает эффективности реиннервации.
Ключевые слова
Об авторе
Список литературы
1. Fuglsang-Frederiksen A. The role of different EMG methods in evaluating myopathy. Clin Neurophysilol 2006;117: 1173–89.
2. Kimura J. Electrodiagnosis in diseases of nerve and muscle: principles and practice (3rd edition). 2001, 1024 p.
3. Федотов В.П., Курбатов С.А., Иванова Е.А. и др. Клинико-электромиографические критерии диагностики наследственных миотонических синдромов. Нервно-мышечные болезни 2012;(3):55–66. [Fedotov V.P., Kurbatov S.A., Ivanova Е.А. et al. Clinical and electromyographic criteria of inherited myotonical syndromes diagnosis. Nervno-mishechnie bolezni = Neuromuscular Diseases 2012;(3):55–66. (In Russ.)].
4. Stеlberg E., Daube J. Elecromyographic methods. In: Handbook of Clinical Neurophysiology 2003;2:147–85.
5. Nandedkar S., Sanders D., Stеlberg E., Andreassen S. Simulation of concentric needle EMG motor unit action potentials. Muscle Nerve 1988;11:151–9.
6. Stеlberg E., Karlsson L. Simulation of EMG in pathological situations. Clin Neurophysiol 2001a;112:869–78.
7. Stеlberg E., Karlsson L. Simulation of the normal concentric needle electromyogram by using a muscle model. Clin Neurophysiol 2001b;112:464–71.
8. Никитин С.С. ЭМГ-анализ развития денервационно-реиннервационного процесса при заболеваниях нейромоторного аппарата у человека. Автореф. дис. … канд. мед. наук. М., 1983. 22 с.[Nikitin S.S. EMG analysis during denervation-reinnervation process development at neuromotor apparatus diseases in man. Abstract of a thesis of … Ph.D. in Medicine. M., 1983. 22 p. (In Russ.)].
9. Bischoff C., Stеlberg E., Falk B. Edebol Eeg-Olofsson K. Reference values of motor unit action potentials obtained with multi-MUP analysis. Muscle Nerve 1994;17:842–51.
10. Гехт Б.М., Касаткина Л.Ф., Кевиш А.В. Электромиография с использованием игольчатых электродов в анализе структуры и функционального состояния двигательных единиц при нервно-мышечных болезнях. Журн неврол и психиатр 1980;80(6):822–9. [Gekht B.M., Kasatkina L.F., Kevish A.V. Electromyography using needle electrodes in analysis of structure and functional status of motor units at neuromuscular diseases. Journal nevrologii i psychiatrii = Journal of Neurology and Psychiatry 1980;80(6):822–9. (In Russ.)].
11. Гехт Б.М., Касаткина Л.Ф., Самойлов М.И., Санадзе А.Г. Электромиография в диагностике нервно-мышечных болезней. Таганрог: ТРТУ, 1997. 370 с. [Gekht B.M., Kasatkina L.F., Samoylov M.I., Sanadze A.G. Electromyography in diagnosis of neuromuscular diseases. Taganrog: Taganrog State Radio Engineering University, 1997. 370 p. (In Russ.)].
12. Касаткина Л.Ф., Гильванова О.В. Электромиографические методы исследования в диагностике нервно-мышечных заболеваний. Игольчатая электромиография. М.: Медика, 2010. 416 с. [Kasatkina L.F., Gilvanova O.V. Electromyography test methods in diagnosis of neuromuscular diseases. Needle Electromyography. M.: Medika, 2010. 416 p. (In Russ.)].
13. Николаев С.Г. Атлас по электромиографии. Иваново. ИПК «ПресСто», 2010. 468 с. [Nikolaev S.G. Atlas of Electro myography. Ivanovo. IPK “PresSto”, 2010. 468 p. (In Russ.)].
14. Stеlberg E., Trontelj J.V., Sanders D. Single fiber electromyography. Edshagen Publishing House, 2010. 400 p.
15. Bertorini T., Stеlberg E., Yuson C., Engel K. Single-fiber electromyography in neuromuscular disorders: correlation of muscle histochemistry, single-fiber electromyography, and clinical findings. Muscle Nerve 1994;17:345–53.
16. Swash M., Schwartz S. Implications of longitudinal muscle fibre splitting in neurogenic and myopathic disorders. J Neurol Neurosurg Psychiatri 1977;40:1152–9.
17. Ciciliot S., Schiaffino S. Regeneration of mammalian skeletal muscle. Basic mechanisms and clinical implications. Curr Pharm Des. 2010;16(8):906–14.
18. Engel W.K. Integrative histochemical approach to the defect of Duchenne muscular dystrophy. In: Rowland L.P. (Ed): Pathogenesis of the muscular dystrophies. NY: American Elsivier, Excerpta Medica, 1977, p. 277–309.
19. Uncini A., Lange D.J., Lovence R.E., et al. Long-duration polyphasic motor unit potentials in myopathies: a quantitative study with pathological correlation. Muscle Nerve 1990;13:263–7.
20. Liguori R., Fuglsang-Frederiksen A., Nix W. et al. Electromyography in myopathy. Neurophysiol Clin 1997;27:200–3.
21. Trojaborg W. Motor unit disorder and myopathies. In: Hallyday A.M., Butler S., Paul R., eds: A Textbook of Clinical Neurophysiology. New York, John Wiley & Sons, 1987, p. 417–438.
22. Trojaborg W. Quantitative electromyography in polymyositis: a reappraisal. Muscle Nerve 1990;13(10):964–71.
23. Zalewska E. Hausmanowa-Petrusewicz I. Effectiveness of motor unit potentials classification using various parameters and indexes. Clinical Neurophysiology 2000;111:1380–7.
24. Rowiñska-Marciñska K. SzmidtSaĺkowska E., Fidziaĺska A. et al. Atypical motor unit potentials in Emery-Dreifuss muscular dystrophy (EDMD). Сlin Neurophysiol 2005;116(11):2520–7.
25. Rowiñska-Marciñska K., Szmidt-Saĺkowska E., Kopeć A. et al. Motor unit changes in inflammatory myopathy and progressive muscular dystrophy. Electromyogr Clin Neurophysiol 2000;40(7):431–9.
26. Pascuzzi R.M., Campa J.F. Lymphorrhage localized to the muscle end-plate on myasthenia gravis. Arch Pathol Lab Med 1988;112:934–7.
27. Maselli R.A., Richman D.P., Willaman R.I. Inflammation at the neuromuscular junction in myasthenia gravis. Neurology 1991;41:1497–504.
28. Cruz Martinez A., Ferrer M.T., Diez Tejedor E. et al. Diagnostic yield of single fiber electromyography and other electrophysiological technique in myasthenia gravis. I. Electromyography, automatic analysis of the voluntary pattern, and repetive nerve stimulation. EMG Clin Neurophysiol 1982;22:377–93.
29. Cruz Martinez A., Ferrer M.T., Peres Conde M.C. et al. Diagnostic yield of single fiber electromyography and other electrophysiological technique in myasthenia gravis. II. Jitter and motor unit fiber density studies. Clinical remission and thymectomy. EMG Clin Neurophysiol 1982;22:395–417.
30. Engel A.G. Molecular biology of end-plate disease. In Salpeter M.M. (ed): The vertebrate neuromuscular junction. New York, Alan R. Liss, 1987; p. 361–424.
31. Engel A.G., Tsujihata M., Lindstrom J.M., Lennon V.A. The motor endplate in myasthenia gravis and in experimental autoimmune myasthenia gravis; a quantative ultrastructural study. Ann Acad Sci 1976;274:60–79.
32. Roberts D.V., Thesleff S. Acetylcholine release from motor nerve endings in rat treated with neostigmine. Eur J Pharmacol 1969;6:281–5.
33. Engel A.G., Lambert E.H., Santa T. Study of anticholinesterase therapy. Effects on neuromuscular transmission and motor endplate structure. Neurology 1973;23:1273–81.
34. Komatsu T., Bokuda K., Shimutzu T. et al. Pseudomyopathic changes in needle electromyography in Lambert-Eaton myasthenic syndrome. Case Rep Neurol Med 2013;2013, AID 3692278: p. 2.
35. Oh S.J. Electromyography: neuromuscular transmission. Baltimore: Williams & Wilkins, 1988.
36. Emeryk-Szajewska B., Kopec J., Karwamska A. The reorganisation of motor units in different motor neuron disease. Muscle Nerve 1997;20(3):306–15.
37. Emeryk-Szajewska B., Kopec J., Karwamska A. The reorganisation of motor units in motor neuron disease. EMG Clin Neurophysiol 2003;43(1):23–31.
38. Emeryk-Szajewska B., Kopec J. Electromyographic pattern in Duchenne and Becker muscular dystrophy. Part I: electromyographic pattern in subsequent stages of muscle lesions in Duchenne muscular dystrophy. EMG Clin Neurophysiol 2008;48(6–7):265–77.
Для цитирования:
Никитин С.С. Электромиографические стадии денервационно-реиннервационного процесса при нервно-мышечных болезнях: необходимость ревизии. Нервно-мышечные болезни. 2015;5(2):16-24. https://doi.org/10.17650/2222-8721-2015-5-2-16-24
For citation:
Nikitin S.S. Electromyographic stages of denervation/reinnervation process in neuromuscular diseases: need for revision. Neuromuscular Diseases. 2015;5(2):16-24. (In Russ.) https://doi.org/10.17650/2222-8721-2015-5-2-16-24
Нервно-мышечные заболевания: миотонии, миастении, полимиазит, ботулизм, столбняк
Для многих заболеваний мышц, нервно-мышечных синапсов, периферических нервов и мотонейронов разработано этиологическое и патогенетическое лечение. В остальных случаях терапия направлена на то, чтобы облегчить симптомы, замедлить прогрессирование заболевания, продлить ремиссию и повысить качество жизни больного. Лечение нервно-мышечных заболеваний требует совместных усилий невропатологов, специалистов по ЛФК, работников социального обеспечения и многих других. Тактика лечения зависит от тяжести и скорости прогрессирования заболевания.
I. Электрофизиологическое исследование
Электрофизиологическое исследование позволяет подтвердить диагноз и следить за динамикой заболевания. Оно включает четыре основные методики.
А. С помощью ЭМГ исследуют электрофизиологические характеристики мышц. При нейрогенной мышечной патологии можно выявить признаки денервации: потенциалы фибрилляции, положительные острые волны, снижение амплитуды интерференционного потенциала, полифазные потенциалы. При первичной мышечной патологии электромиографическая картина неспецифична и вариабельна; наиболее характерный признак — снижение амплитуды потенциалов. Изменения ЭМГ, характерные для миотонии и миастении, описаны в п. VI и XIII.
Б. Скорость распространения возбуждения по двигательным волокнам рассчитывают исходя из времени от момента нанесения на нерв стандартного раздражения до возникновения колебания потенциала на ЭМГ и длины нервного волокна от точки раздражения до мышцы. С помощью этого метода исследуют нервы конечностей и лицевой нерв. Скорость распространения возбуждения может оставаться нормальной в первые 7 сут после перерыва нерва, а денервационные изменения — появляться только на 10–21-е сутки. При аксонопатиях (обусловленных, например, нарушениями питания) скорость распространения возбуждения в большинстве случаев падает незначительно, нередко — лишь до нижней границы нормы. В то же время при нейропатиях, обусловленных демиелинизацией (миелинопатиях), скорость распространения возбуждения значительно уменьшается. Выраженным снижением скорости распространения возбуждения сопровождаются синдром Гийена-Барре, дифтерийная полинейропатия, болезнь Шарко-Мари-Туса, метахроматическая лейкодистрофия, туннельные нейропатии. При полной дегенерации нерва определить скорость распространения возбуждения невозможно.
В. Скорость распространения возбуждения по чувствительным волокнам рассчитывают по времени прохождения вызванного потенциала по участку нерва между раздражающим и регистрирующим электродами. На руке обычно исследуют срединный, локтевой и лучевой нервы, на ноге — икроножный, подкожный, глубокий малоберцовый нервы и латеральный кожный нерв бедра. Можно исследовать скорость распространения возбуждения и по смешанным нервам. По изменению скорости распространения возбуждения и амплитуды потенциалов действия (по чувствительным или смешанным нервам) можно диагностировать туннельные нейропатии, а также дифференцировать аксонопатии и миелинопатии.
Г. Поздние ответы
1. Рефлекс Гофмана (H-рефлекс) — это электрофизиологический эквивалент сухожильного рефлекса, позволяющий оценить состояние как двигательных, так и чувствительных волокон. У взрослых можно вызвать H-рефлекс только икроножной мышцы. Для этого на большеберцовый нерв наносят субмаксимальное раздражение, которое по двигательным волокнам проводится к икроножной мышце, а по чувствительным волокнам группы IA достигает спинного мозга и передается через синапс на мотонейрон. При этом возникает как быстрая прямая реакция, так и поздний H-рефлекс. Удлинение латентного периода H-рефлекса или его отсутствие может быть единственным электрофизиологическим проявлением нейропатии. Удлинение латентного периода H-рефлекса характерно также для радикулите S1 и может отмечаться при синдроме Гийена-Барре.
2. F-ответ исследуют на руках и ногах. Его получают с помощью супрамаксимальной стимуляции периферического нерва, вызывающей антидромное распространение возбуждения по двигательным волокнам вплоть до мотонейронов передних рогов спинного мозга (без синаптических переключений). Часть этих мотонейронов возбуждается, импульсы от них ортодромно распространяются к мышцам, и возникает колебание потенциала на ЭМГ (F-ответ). Величина латентного периода H-рефлекса и F-ответа зависят от роста больного. Увеличение латентного периода поздних ответов может наблюдаться при нейропатиях и радикулите даже в том случае, когда другие электрофизиологические показатели остаются нормальными. Однако только на основании F-ответа делать вывод о наличии радикулита нельзя.
Д. При определении скорости распространения возбуждения можно использовать не электрическую, а магнитную стимуляцию. Современная техника не позволяет точно нанести раздражение, поэтому метод применяется редко, главным образом для диагностики радикулита.
II. Биопсия мышцы
Биопсия мышц — безопасный и информативный метод диагностики.
1. Прогрессирующая атрофия мышц.
2. Локальный или диффузный миозит.
3. Подозрение на коллагеноз или васкулит.
4. Необходимость оценки состояния мышц после травмы периферических нервов или сосудов.
5. Подозрение на врожденную или метаболическую миопатию.
Б. Целесообразно, чтобы гистолог присутствовал при биопсии и следил за тем, чтобы она была произведена в нужном месте и с соблюдением всех правил. Объем исследований планируется заранее. Непосредственно в операционной биоптат фиксируют для световой и электронной микроскопии и при необходимости гистохимического окрашивания замороженных срезов. Из участков, в которые вставлялись игольчатые электромиографические электроды, биоптат не берут, поскольку из-за травмы он может быть непригодным для исследования.
III. Биопсия нерва
Биопсию нерва иногда проводят для уточнения этиологии заболевания, но, поскольку после этого исследования (в частности, биопсии икроножного нерва) может оставаться болезненная дизестезия, лучше обойтись другими диагностическими методами.
А. Данные биопсии нерва бывают патогномоничными при саркоидозе, метахроматической лейкодистрофии, амилоидозе, узелковом периартериите, проказе, токсических и наследственных нейропатиях.
Б. При остальных нервно-мышечных заболеваниях (то есть в большинстве случаев) изменения при биопсии нерва неспецифичны, и ее диагностическая ценность ограничена. Исключение составляет дифференциальный диагноз между аксональной дегенерацией и сегментарной демиелинизацией с помощью электронной микроскопии.
IV. Принципы длительной кортикостероидной терапии
Решение о кортикостероидной терапии должно быть взвешенным, а во время курса лечения необходимо тщательное наблюдение. Осложнения зависят от дозы и длительности лечения. Поэтому если кортикостероидная терапия не дает эффекта, ее надо прекратить. Обычно кортикостероиды назначают лишь при неэффективности других средств, однако при нервно-мышечных заболеваниях иного выбора часто нет. Уменьшить дозу гормонов иногда можно добавлением других, менее опасных средств.
А. Основные осложнения кортикостероидной терапии — синдром Кушинга, сахарный диабет, остеопороз, активизация туберкулеза, артериальная гипертония, психоз, снижение сопротивляемости инфекциям. У части больных длительный прием высоких доз кортикостероидов повышает риск язвы желудка и желудочного кровотечения.
Б. При отмене кортикостероидов возможны 3 вида осложнений.
1. Осложнения, связанные с угнетением функции надпочечников (гипоталамо-гипофизарно-надпочечниковой системы). Это угнетение почти всегда развивается при дробном приеме преднизона в дозе, превышающей 20–30 мг/сут (или эквивалентной дозы другого кортикостероида) в течение более одной недели. Полное восстановление занимает до одного года. При дозах, более близких к физиологическим, функция надпочечников обычно остается сохранной, если длительность лечения не превышает 1 мес. После обычных доз кортикостероидов заместительной терапии, как правило, не требуется, за исключением периодов острых заболеваний или иных стрессовых ситуаций.
2. Общие симптомы отмены (анорексия, тошнота, рвота, сонливость, головная боль, лихорадка, миалгия и артралгия, потеря веса) более вероятны после длительной терапии. Лечение: симптоматические меры и малые дозы кортизона (10 мг/сут) в течение нескольких недель.
3. Обострение основного заболевания — одно из наиболее опасных осложнений отмены кортикостероидов. Его риск уменьшается при постепенном снижении дозы.
В. Выбор препарата
1. Кортикостероиды предпочтительнее кортикотропина, поскольку их можно принимать внутрь, более точно дозировать, а побочных эффектов меньше. Кроме того, при лечении кортикостероидами их концентрация в крови не зависит от функции надпочечников. Преимущество кортикотропина в том, что он не подавляет функцию надпочечников, однако того же можно добиться, назначая кортикостероиды короткого действия через день.
2. Преднизон — препарат короткого действия для приема внутрь, чаще всего применяемый при нервно-мышечных заболеваниях. Преднизон (как и кортизон) активируется в печени, поэтому при печеночной недостаточности предпочтительнее использовать активированные парентеральные формы (преднизолон или кортизон).
Г. Схемы лечения
1. Эквивалентные дозы кортикостероидов указаны в табл. 16.1. Препарат можно назначать ежедневно (в несколько приемов или однократно утром) или через день (однократно утром). При коротком курсе (менее месяца) схема приема не имеет существенного значения. При длительном лечении дробный ежедневный прием способствует развитию синдрома Кушинга, угнетению функции надпочечников и снижает сопротивляемость инфекциям.
2. Ежедневный прием. При длительном курсе однократный утренний прием суточной дозы препарата короткого действия реже вызывает угнетение надпочечников (хотя и не предотвращает синдром Кушинга); эффект же такой схемы при большинстве заболеваний тот же, что и дробного приема в течение суток. Поэтому для длительного курса схема с однократным приемом лучше.
3. При приеме через день удвоенной суточной дозы реже развиваются угнетение надпочечников, синдром Кушинга и снижение сопротивляемости инфекциям. Эта схема эффективна при большинстве нервно-мышечных заболеваний. Кортикостероиды длительного действия (например, дексаметазон) назначать по схемам ежедневного утреннего приема или приема через день нецелесообразно, так как отсутствует необходимый для предупреждения побочных эффектов период низкой сывороточной концентрации кортикостероидов.
4. Для перехода с ежедневной схемы на прием через день утреннюю дозу в один день постепенно уменьшают, а во второй соответственно увеличивают. Если же препарат назначен дробными дозами, то постепенно снижают кратность приема, одновременно увеличивая утреннюю дозу — пока вся суточная доза не будет перенесена на утро.
V. Миопатии
А. Общие сведения
1. Миопатии — группа наследственных заболеваний, проявляющихся мышечной слабостью и атрофией мышц. Прогрессирующие миопатии называют также миодистрофиями. Гистологически выявляются снижение числа мышечных волокон и вариабельность размеров оставшихся. При амиотрофиях (атрофиях мышц при поражениях двигательных нервов или мотонейронов) патологоанатомическая картина иная. Существует несколько типов миопатий (см. табл. 16.2).
2. Тяжесть и скорость прогрессирования заболевания зависит от типа миопатии и индивидуальных особенностей. Наиболее тяжело протекает миопатия Дюшенна, при которой большинство больных не доживают до 20 лет. При других миопатиях больные достигают зрелого возраста. Существуют легкие формы миопатий, поражающие лишь определенные группы мышц и практически не ограничивающие жизнедеятельность.
3. Патогенез большинства миопатий остается неизвестным. Недавно показано, что в основе этих заболеваний может лежать дефект мембраны мышечных клеток. Миопатии Дюшенна и Беккера связаны с делецией в локусе Xp21 (на коротком плече X-хромосомы). При миопатии Дюшенна в мембране мышечных клеток отсутствует продукт данного гена — дистрофин, а при более доброкачественной миопатии Беккера наблюдается снижение содержания дистрофина либо выявляется дистрофин с аномальным молекулярным весом. Патогенез других миопатий менее изучен.
Б. Диагностика
1. Выявление в анамнезе и при осмотре у детей и подростков прогрессирующей слабости и похудания мышц позволяет заподозрить миопатию. Однако по клиническим данным невозможно полностью отличить миопатию от амиотрофии. Различные типы миопатий отличаются друг от друга преимущественным поражением тех или иных мышечных групп, скоростью прогрессирования и другими клиническими проявлениями (см. табл. 16.2). В табл. 16.3 приведены признаки, позволяющие отличить амиотрофии от миопатий.
2. Биопсия мышц подтверждает диагноз миопатии и позволяет отличить тяжелые прогрессирующие миопатии от доброкачественных непрогрессирующих (например, от болезни центрального стержня или немалиновой миопатии). Биоптат берут из пораженной, но не наиболее ослабленной мышцы. Чаще всего при миопатиях исследуют дельтовидную и икроножную мышцы, хотя целесообразней проводить биопсию прямой мышцы живота — это не нарушает двигательную активность больного и не приводит к дальнейшему нарастанию слабости вследствие бездействия.
3. Исследование ДНК лейкоцитов с помощью ПЦР выявляет дефект у 70% больных с миопатией Дюшенна и Беккера. Данным методом можно также исследовать культуру ткани плода. Исследование дистрофина в мышечном биоптате позволяет отличить миопатии Дюшенна и Беккера друг от друга и от других миопатий, при которых содержание и структура дистрофина не меняются. Хотя сочетание этих двух методов значительно повышает точность диагноза, в большинстве случаев биопсию не проводят, если при исследовании ДНК лейкоцитов обнаружена характерная делеция.
В. Лечение
1. В легких случаях лечение, особенно на ранней стадии, не требуется; достаточно повторных (каждые 6–12 мес) исследований двигательной функции.
2. В тяжелых случаях, особенно при миопатии Дюшенна, необходимо разъяснить родственникам суть и прогноз заболевания и заручиться их поддержкой.
а. Скрупулезное выполнение назначений врача способно продлить период относительной независимости больного, и семья должна это хорошо понимать. По мере прогрессирования заболевания часто наступает разочарование, однако и в этой ситуации важно поддерживать надежду на стабилизацию процесса и настаивать на продолжении физических упражнений.
б. Поскольку большую часть больных с миопатиями составляют дети, необходимо предусмотреть возможность получения образования и общения со сверстниками. Пока ребенок может без особого труда подниматься по лестнице, он должен посещать обычную школу. В то же время при миопатии Дюшенна интеллект часто снижается (IQ у многих больных составляет менее 90). В таких случаях детей лучше сразу направлять в специальную школу.
в. Цель лечения состоит не только в том, чтобы сохранить способность к самостоятельному передвижению. Болезнь не должна заполнять все существование больного — следует стремиться к тому, чтобы он как можно дольше вел нормальный образ жизни.
3. Преднизон (0,75 мг/кг/сут) способствует увеличению мышечной силы при миопатии Дюшенна. Однако его польза не перевешивает риск побочных эффектов, и поэтому его обычно не назначают. Исключение составляют случаи, когда в результате пневмонии или ателектаза развиваются острые дыхательные расстройства. Чтобы избежать прибавки в весе, во время лечения назначают диету с низким содержанием жиров и соли. При возможном контакте с вирусом varicella-zoster больным, принимающим кортикостероиды, назначают иммуноглобулин против вируса varicella-zoster.
4. Ударно-волновая терапия (УВТ) показала свою высокую эффективность для предотвращения прогрессирования большинства миопатий. Точный механизм воздействия УВТ при лечении миопатий пока не известен.
5. ЛФК
а. Тренировки начинают как можно раньше. Больного и его родных следует обучить комплексам упражнений. ЛФК более эффективна, если ее начинают до появления контрактур и деформаций.
б. Цель ЛФК — обеспечить функционирование опорных суставов и предотвратить контрактуры. Так как сгибатели поражаются в несколько меньшей степени, чем разгибатели, контрактуры (в тазобедренных, локтевых и коленных суставах) обычно носят сгибательный характер.
в. Для профилактики контрактур, затрудняющих передвижение и усложняющих уход за больным, необходимы упражнения на объем движений, коррекция положения тела в кровати и кресле, частая смена позы, раннее применение шин.
г. Хотя нет доказательств, чтоЛФКзамедляет прогрессирование болезни, она тем не менее позволяет отсрочить на несколько лет обездвиженность.
6. Лечение дыхательных расстройств
а. В тяжелых случаях генерализованной миопатии и при поражении мышц гортани и глотки возникают нарушения глотания и дыхания. Дыхательная недостаточность обычно нарастает постепенно и становится явной лишь на поздней стадии.
б. При исследовании функции внешнего дыхания часто выявляются нарушения даже в отсутствие явных дыхательных расстройств. Целесообразно тренировать диафрагмальное дыхание (надувать игрушки или играть на духовых инструментах). Необходимы и специальные дыхательные упражнения под контролем инструктора.
в. На поздней стадии приходится прибегать к ИВЛ и постуральному дренажу.
г. Гиперкапния в отсутствие пневмонии — плохой прогностический признак, поскольку 80% больных с тяжелой миопатией погибает от дыхательной недостаточности. К интубации трахеи при миопатиях прибегают редко.
7. Поддержание подвижности
а. Уменьшение избыточного веса улучшает двигательные возможности и предотвращает гиповентиляцию.
б. Целесообразны ежедневные пешие прогулки продолжительностью не менее 3 ч. Если больной не может ходить, то ему рекомендуют стоять в общей сложности 3 ч в сутки (по 30 мин каждые 3–4 ч).
в. По мере прогрессирования заболевания при ходьбе можно использовать костыли и другие ортопедические приспособления. К передвижению в кресле-каталке переходят как можно позже.
г. При острых сопутствующих заболеваниях слабость может усиливаться, однако постельный режим обычно противопоказан, так как он приводит к еще большему нарастанию мышечной слабости и некоторые больные больше уже никогда не встают.
8. Профилактика и медико-генетическое консультирование. Если тип наследования заболевания известен, можно предсказать вероятность его развития у ребенка. Больным с миопатиями следует обязательно сообщать степень риска для их будущего потомства.
а. Сцепленные с полом рецессивные заболевания (миопатии Дюшенна и Беккера)
1) Наследование. Вероятность рождения у носителя патологического гена больного сына или дочери-носительницы составляет 50%. Однако примерно у трети больных заболевание в семейном анамнезе отсутствует.
2) Выявление носителей. Примерно у половины носителей в сыворотке увеличена активностьКФК. Поскольку активность КФК может колебаться, исследование нужно проводить по меньшей мере 3 раза с интервалом в 10 сут. Накануне взятия крови ограничивают нагрузки, так как они приводят к повышению КФК. Нормальные результаты не исключают возможность носительства. В 60–65% семей с миопатиями Дюшенна или Беккера выявляются характерные мутации в виде интрагенных делеций гена дистрофина. Носительниц в семье больного мальчика можно выявить путем обнаружения делеции в одном из двух аллелей, кодирующих дистрофин. В других случаях используют метод, основанный на анализе полиморфизма длин рестрикционных фрагментов. Точность выявления носительства у девочек достигает 85–90%.
3) Профилактика. Носители могут предотвратить рождение больного ребенка с помощью нескольких способов.
а) Добровольная стерилизация или контрацепция.
б) Пренатальные определение пола и диагностика позволяют произвести аборт по медицинским показаниям.
4) Спонтанная мутация лежит в основе трети случаев миопатии Дюшенна. Чем больше здоровых детей родилось в семье до появления больного ребенка, тем меньше вероятность, что мать является носителем. В этом случае вероятность рождения у нее еще одного больного ребенка невелика.
б. Аутосомно-доминантные заболевания (плече-лопаточно-лицевая миопатия, поздняя дистальная миопатия)
1) Наследование. В типичном случае плече-лопаточно-лицевая дистрофия передается по аутосомно-доминантному типу, однако существуют другие формы с аналогичной клинической картиной, которые наследуются по аутосомно-рецессивному или сцепленному с полом рецессивному механизму. Тяжесть заболевания варьирует. При аутосомно-доминантном типе наследования вероятность передачи заболевания потомству составляет 50%.
2) Носительства не бывает.
3) Профилактика возможна с помощью контрацепции. Если болен мужчина, то для появления здорового потомства можно прибегнуть к искусственному оплодотворению.
в. Аутосомно-рецессивные заболевания (тазо-плечевая миопатия)
1) Наследование. Если оба родителя являются носителями, то один из четырех детей будет болен, два из четырех будут носителями и только один будет полностью здоров.
2) Профилактика: контрацепция и воздержание от близкородственных браков.
VI. Миотонии
А. Общие сведения
1. При атрофической миотонии из-за поражения мимических и шейных мышц лицо невыразительно, особенно заметно ограничение подвижности рта. Развиваются птоз и атрофия мышц кистей и предплечий.
2. Характерно замедленное и неполное расслабление мышц после сокращения. При постукивании по возвышению большого пальца или языку выявляется перкуссионная миотония. При атрофической миотонии мышечные спазмы обычно выражены слабо, при врожденной миотонии (болезни Томсена) — резко.
3. Миотония наблюдаются также при семейном гиперкалиемическом периодическом параличе.
4. На ЭМГ при постоянной стимуляции амплитуда мышечных потенциалов неуклонно (без фазы плато) снижается, а после произвольного сокращения мышцы регистрируются характерные нерегулярные миотонические разряды.
5. При атрофической миотонии часто встречаются гипогонадизм, катаракта, умственная отсталость, дисфункция пищевода и другие расстройства.
6. Атрофическая миотония обычно передается по аутосомно-доминантному типу и может проявляться как в раннем детском возрасте, так и у взрослых.
Б. Лечение
1. Для лечения спазмов при атрофической и врожденной миотонии применяют одни и те же лекарственные средства, действующие на мембраны мышечных клеток.
а. Препарат выбора — фенитоин (5 мг/кг/сут внутрь), так как он достаточно эффективен и в наименьшей степени влияет на сердце.
б. Прокаинамид, до 50 мг/кг/сут внутрь в 3–4 приема.
в. Хинин, 5–10 мг/кг/сут внутрь в 6 приемов.
г. Кортикостероиды показаны в тяжелых случаях (см. гл. 16, п. IV).
д. Диазепам неэффективен.
2. Лечение дыхательных нарушений. При миотонии межреберных мышц могут развиваться дыхательные расстройства, при этом миотония в конечностях иногда выражена слабо. При атрофической миотонии в патологический процесс часто вовлекаются мышцы рта и глотки, что может приводить к аспирационной пневмонии.
3. Лечение атрофической миотонии зависит от ее тяжести. Обычно слабость беспокоит гораздо больше, чем миотония, и назначать противомиотонические препараты часто нет необходимости.
VII. Полимиозит
А. Общие сведения
1. Полимиозит — воспалительное аутоиммунное заболевание мышц, проявляющееся слабостью и утомляемостью. Течение вариабельно, наблюдаются обострения и ремиссии, которые могут возникать под влиянием терапии или спонтанно. К неблагоприятным прогностическим признакам относятся наличие онкологического заболевания, вовлечение сердечной мышцы, пожилой возраст, позднее начало лечения. При полимиозите страдают и внутренние органы. Часто возникает интерстициальное поражение легких.
2. Клиническая картина вариабельна, однако наиболее характерна слабость проксимальных мышц. При наблюдающемся иногда остром течении за несколько недель может развиться полная обездвиженность. В части случаев отмечается подострое течение, при котором слабость нарастает в течение нескольких месяцев. Лицевые мышцы обычно не страдают, а мышечные атрофии развиваются лишь на поздней стадии. При поражении глоточной мускулатуры появляется дисфагия, но речь обычно остается нормальной. Часто вовлекаются задние шейные мышцы. Иногда появляются эритематозные высыпания на тыле кистей, проксимальных фалангах пальцев, в области коленных и локтевых суставов, а также характерный периорбитальный отек с эритемой. У некоторых развивается склеродактилия. Полимиозит с кожными проявлениями называют дерматомиозитом (лечение такое же, как при полимиозите). Сердце поражается в 30% случаев. При остром начале может возникать миоглобинурия.
Б. Диагностика
1. Активность мышечных ферментов (КФК, аминотрансфераз, фруктозодифосфатальдолазы) обычно повышена, хотя иногда бывает нормальной.
2. СОЭ не коррелирует с активностью заболевания.
3. На ЭМГ выявляются неспецифические изменения, характерные для первичного поражения мышц (короткие низкоамплитудные полифазные потенциалы действия двигательных единиц). Однако нередко регистрируются также положительные острые волны, потенциалы фибрилляций и повторные высокочастотные разряды.
4. При биопсии мышц в 85–90% случаев обнаруживают воспалительные инфильтраты и некроз мышечных волокон. Часто для того, чтобы подтвердить диагноз, приходится проводить повторную биопсию.
5. Дифференциальный диагноз обычно несложен, но требует применения вышеуказанных методов (включая биопсию). Полимиозит дифференцируют с пароксизмальной миоглобинурией, трихинеллезом, ревматической полимиалгией, врожденными миопатиями, тиреотоксической или другими эндокринными миопатиями, диабетической амиотрофией.
6. Связь со злокачественными новообразованиями. Полимиозит традиционно считался спутником скрыто протекающих онкологических заболеваний, однако последние исследования показывают, что это далеко не всегда так. Тем не менее частота злокачественных новообразований у больных с истинным полимиозитом (который следует отличать от мышечных атрофий при раковой кахексии) достигает 20%; она выше при дерматомиозите и при денервационных изменениях на ЭМГ.
В. Лечение
1. Кортикостероиды
а. Кортикостероиды, несомненно, оказывают благоприятное действие при полимиозите, хотя контролируемые испытания не проводились. Кортикостероиды не уменьшают смертность, но способствуют более быстрому наступлению ремиссии и уменьшают выраженность осложнений. Часто их сочетают с метотрексатом или азатиоприном.
б. Особенно хороший эффект кортикостероиды оказывают в ранней стадии острого полимиозита; напротив, при хроническом полимиозите и мышечных атрофиях эффект может отсутствовать. Если при хроническом полимиозите лечение не приводит к улучшению в течение двух месяцев, переходят на иные средства (см. п. VII.В.2).
1) Начальная доза преднизона обычно составляет 60–100 мг (ежедневно однократно утром). После улучшения дозу снижают до 40 мг и лечение проводят еще несколько месяцев.
2) Чтобы избежать рецидива, дозу снижают медленно — на 5–10 мг каждые 3–7 сут. По мере того как суточная доза уменьшается, эти 5–10 мг становятся все больше в процентном отношении, и поэтому интервалы между снижениями дозы должны увеличиваться. После того как доза станет равной двум третям от первоначальной, дальнейшее снижение прекращают на несколько месяцев. Через 6–12 мес большинство больных переводят на поддерживающую дозу (15–20 мг преднизона однократно утром). При стабильной ремиссии можно перейти на прием через день (по 30–40 мг). При обострении приходится возвращаться к высоким дозам. Об эффективности лечения и о развитии рецидива можно судить по активности мышечных ферментов.
3) Попытку отменить кортикостероиды следует предпринять через 24 мес лечения, поскольку к этому времени активность заболевания часто снижается. В большинстве случаев достигается устойчивая 8-летняя ремиссия.
4) При активном полимиозите низкие дозы кортикостероидов не позволяют добиться ремиссии.
г. Стероидная миопатия, возникающая у больных с хроническим полимиозитом, осложняет лечение. Ее следует заподозрить при нарастании мышечной слабости, если нет увеличения активности мышечных ферментов и ухудшения на ЭМГ. Морфологическим признаком стероидной миопатии является преимущественная атрофия волокон 2 типа. Однако для подтверждения диагноза биопсии обычно не требуется — достаточно клинического улучшения при снижении дозы кортикостероидов. Дозу обычно снижают до поддерживающей под контролем активности мышечных ферментов. Если она повышается, а слабость нарастает, вновь переходят к высоким дозам. Стероидная миопатия чаще развивается у женщин, поэтому им по возможности назначают более низкие дозы.
д. Наблюдение. Активность мышечных ферментов (АсАТ, КФК, фруктозодифосфатальдолазы и др.) обычно достаточно хорошо отражает активность патологического процесса, однако иногда активность всех или почти всех ферментов остается нормальной даже при обострении. С другой стороны, активность ферментов может снижаться за несколько недель до клинического улучшения и повышаться перед обострением.
2. Иммуносупрессивная терапия
а. Показания: хронический прогрессирующий полимиозит, неэффективность или непереносимость кортикостероидов.
б. Иммунодепрессанты применяют в сочетании с кортикостероидами (для уменьшения дозы последних) или самостоятельно.
а) Дозы. При неэффективности кортикостероидов добавление метотрексата приводит к улучшению в 75% случаев. Препарат вводятв/вв течение 20–60 мин. При нормальной функции печени и почек начинают с 0,4 мг/кг, затем в течение 2–3 нед дозу увеличивают до 0,8 мг/кг.
б) Частота введения. Вначале препарат вводят еженедельно. При положительном эффекте переходят на введение через две, а затем через три недели. После достижения максимального улучшения препарат вводят один раз в месяц в течение 10–24 мес. По мере стихания активности дозу кортикостероидов снижают.
в) Побочные эффекты метотрексата проявляются стоматитом и другими расстройствами ЖКТ, которые обычно проходят при уменьшении дозы. Возможны поражение печени и лейкопения; в тяжелых случаях препарат приходится отменять.
2) Азатиоприн применяют внутрь в дозе 1,5–2 мг/кг самостоятельно или в сочетании с преднизоном. При добавлении азатиоприна к преднизону эффект может долго не наступать. Препарат назначают также на длительный срок при неэффективности или непереносимости преднизона. Дозу постепенно увеличивают, пока в крови не снизится количество лейкоцитов, после чего лечение продолжают в этой же дозе вплоть до достижения ремиссии. Основные побочные эффекты: угнетение кроветворения, анорексия, тошнота, рвота, желтуха.
3. Относительно новым, но исключительно результативным методом в лечении полимиозита является ударно-волновая терапия. Доказано, что высокоэнергетические сфокусированные импульсы эффективно разрушают иммунные комплексы, позволяя в разы снизить дозы кортикостероидной и иммуносупрессивной терапии и даже совсем отказаться от медикаментозной терапии.
4. Другие лечебные мероприятия
а. В острой стадии необходим постельный режим.
б. Добившись улучшения, сразу же начинаютЛФК, прежде всего упражнения на объем движений.
в. При длительной слабости используют корсеты и другие ортопедические приспособления.
VIII. Трихинеллез
А. Общие сведения
1. Распространенность. В США ежегодно регистрируют 300 новых случаев трихинеллеза. Возбудитель заболевания — Trichinella spiralis, относящаяся к классу круглых червей и поражающая скелетные мышцы.
2. Эпидемиология. Чаще всего заражение происходит при употреблении в пищу недостаточно обработанной свинины (в настоящее время поросят реже откармливают сырыми отброс ами, поэтому распространенность трихинеллеза среди них уменьшилась). Источником заражения бывает также мясо медведей и моржей.
3. Клиническая картина отражает миграцию трихинелл из ЖКТ по лимфатическим сосудам в кровоток, а затем к скелетным мышцам, где образуются инкапсулированные личинки. Вначале на фоне небольшой лихорадки остро появляются тошнота, рвота и понос. Типичны отечность лица и век, утомляемость. Позже присоединяются миалгии и болезненность мышц при пальпации. Иногда поражение отдельных мышц проявляется очаговыми симптомами (например, диплопией), но чаще развивается умеренная генерализованная мышечная слабость. Уже на ранней стадии появляется эозинофилия, а при биопсии мышц часто удается обнаружить личинки.
4. Течение. Первые симптомы возникают через 2–3 сут после инвазии. Улучшение обычно начинается спустя 4 нед. По прошествии 2 мес все симптомы обычно проходят. Летальные исходы редки. Тяжесть заболевания зависит от количества попавших в организм паразитов.
Б. Лечение
1. Кортикостероиды уменьшают выраженность симптомов. В первые 1–2 сут назначают преднизон по 60 мг/сут, затем дозу уменьшают до 20 мг/сут и продолжают лечение в течение 7–10 сут или вплоть до улучшения.
2. Тиабендазол назначают внутрь по 25 мг/кг 2 раза в сутки в течение 10 сут. Он разрушает капсулы личинок трихинелл и уменьшает выраженность симптомов в острой стадии. Примерно у половины больных препарат оказывает побочные эффекты (анорексия, тошнота, рвота, головокружение, головная боль, сонливость, повышение активности печеночных ферментов).
IX. Рабдомиолиз
А. Общие сведения
1. Дыхательная недостаточность вследствие слабости дыхательных мышц (развивается редко).
2. Гиперкалиемия, обусловленная некрозом мышц, может быть причиной угрожающих жизни нарушений ритма сердца.
3. ОПН возникает при высокой концентрации миоглобина в крови.
Б. Лечение: строгий постельный режим, осмотический диурез для предотвращения почечной недостаточности, поддержание электролитного баланса.
X. Гликогенозы
1. Общие сведения. Характерный признак недостаточности мышечной фосфорилазы — боли и напряжение в мышцах, возникающие у молодых лиц при физической нагрузке. После нагрузки содержание лактата в крови не повышается. Слабость и атрофия мышц отмечаются редко. При выраженном мышечном напряжении может происходить укорочение мышц. При ЭМГ в этих случаях выявляют контрактуру мышц на фоне «электрического молчания». При биопсии определяется увеличение содержания в мышцах гликогена.
а. Больные обычно непроизвольно ограничивают физические нагрузки, что облегчает их состояние на ранней стадии заболевания.
б. Прием глюкозы или фруктозы (20–45 г 3 раза в сутки) повышает переносимость физической нагрузки, но приводит к ожирению.
в. Лекарственные средства, повышающие концентрацию свободных жирных кислот:
1) фенфлурамин (по 20 мг 2 раза в сутки),
2) изопреналин (10–20 мг/сут).
г. Глюкагон вызывает гипергликемию и поэтому может применяться у части больных для увеличения переносимости физической нагрузки.
Б. Болезнь Помпе (гликогеноз типа II, недостаточность лизосомной альфа-D-глюкозидазы)
2. Эффективного лечения нет, хотя сообщалось о некотором улучшении на фоне диеты с высоким содержанием белков и жиров. Предпринимаются попытки трансплантации костного мозга.
В. Недостаточность фосфофруктокиназы (гликогеноз типа VII)
XI. Дефицит карнитина
А. Существуют две формы врожденного дефицита карнитина, передающиеся по аутосомно-рецессивному типу.
1. Генерализованная форма проявляется в раннем детстве обострениями, напоминающими синдром Рейе (острая энцефалопатия, гипогликемия, гипоаммониемия, увеличение активности печеночных ферментов, удлинение ПВ). Обострения провоцируются голоданием и могут возникать на фоне острых инфекций, протекающих с лихорадкой. Пониженная концентрация карнитина определяется в печени, мышцах, а также (хотя и не всегда) в сыворотке.
2. Миопатическая форма проявляется прогрессирующей миопатией различной тяжести. Эпизоды энцефалопатии и поражение печени не характерны. Уровень карнитина в печени и сыворотке в пределах нормы, в мышцах — снижен.
Б. Лечение: левокарнитин, 2 г/сут внутрь (не всегда эффективен).
XII. Пароксизмальныйе миоплегии
А. Семейный гипокалиемический периодический паралич
а. Аутосомно-доминантное заболевание, проявляющееся в 10–20 лет. Мужчины страдают в 3 раза чаще.
б. Заболевание обычно начинается с внезапной слабости во всех конечностях. Дыхательная и глотательная мускулатура, как правило, не страдает. Поражение мышц может быть асимметричным.
в. Приступы часто возникают по утрам и продолжаются (в отсутствие лечения) от 1 до 36 ч. Отмечаются слабость и снижение тонуса мышц. Сухожильные рефлексы могут отсутствовать. Приступы могут развиваться после употребления большого количества углеводов, во время отдыха после интенсивной физической нагрузки, в холодную погоду.
г. Концентрация калия в плазме снижается до 2–3 мэкв/л. Другие биохимические показатели не меняются.
д. На ЭМГ выявляется снижение возбудимости мышц. При исследовании биоптата, полученного во время приступа, в пораженных мышечных волокнах обнаруживаются крупные вакуоли.
е. При гиперальдостеронизме и тиреотоксикозе также могут наблюдаться приступы мышечной слабости и гипокалиемия. Сочетание пароксизмальной миоплегии с тиреотоксикозом особенно часто наблюдается у азиатов.
а. Во время приступа. Высокие дозы хлорида калия внутрь (10–15 г в виде раствора) или в/в (40–60 мэкв калия в 500 мл 5% глюкозы в течение нескольких часов) позволяют оборвать приступ.
б. В межприступный период
1) Диета с высоким содержанием калия и ограничением углеводов и натрия.
2) Спиронолактон, по 100 мг внутрь 1–2 раза в сутки.
3) Тиамин, 50–100 мг/сут.
4) Лечение тиреотоксикоза.
5) Диклофенамид (25–50 мг 3 раза в сутки внутрь) или ацетазоламид (250–500 мг 4–6 раз в сутки) с целью вызвать легкий метаболический ацидоз.
Б. Семейный гиперкалиемический периодический паралич
а. Заболевание одинаково часто встречается у лиц обоего пола. Наследуется по аутосомно-доминантному типу. Проявляется обычно в детском возрасте.
б. Приступы протекают легче и короче (30–90 мин), чем при гипокалиемическом параличе. Слабость возникает преимущественно в мышцах туловища и проксимальных отделов конечностей, дыхательная мускулатура не страдает. В мышцах языка, кистей и век может выявляться легкая миотония.
в. На ЭМГ в межприступный период выявляется повышенная возбудимость мышц, а во время приступа — миотонические разряды. Концентрация калия в сыворотке повышена или находится на верхней границе нормы.
а. Во время приступа
1) В большинстве случаев приступы быстро проходят и не требуют лечения.
2) Оборвать приступ можно с помощьюв/ввведения 10–20 мл 10% глюконата кальция.
б. В межприступный период
1) Ацетазоламид, 250 мг 4 раза в сутки внутрь, или диклофенамид, 25–50 мг 3 раза в сутки внутрь.
2) Хлортиазид, 50–100 мг/сут внутрь.
XIII. Миастения
А. Общие сведения. Генерализованная миастения характеризуется мышечной слабостью и прогрессирующим снижением переносимости физической нагрузки. Единственным проявлением глазной формы миастении может быть диплопия без зрачковых нарушений. Иногда при длительном течении развивается умеренная атрофия мышц. Течение вариабельное, с обострениями и ремиссиями, что затрудняет оценку эффективности терапии. В большинстве случаев симптомы достигают максимальной выраженности уже на первом году заболевания, но возможно и многолетнее прогрессирование. Для того чтобы прогнозировать течение заболевания и выбирать терапию, выделяют несколько основных форм миастении.
1. Глазная миастения (14% случаев).
2. Легкая генерализованная миастения с глазными симптомами.
3. Умеренная генерализованная миастения с легкими бульбарными и глазными симптомами.
4. Острая тяжелая миастения с бульбарными и дыхательными нарушениями (показана трахеостомия).
5. Поздняя тяжелая миастения (конечная стадия других форм миастении, развивается в течение двух лет от начала болезни).
Б. Диагностика
1. Проба с эдрофонием
а. Предварительный диагноз. В пользу миастении говорит преходящее уменьшение дефекта после введения эдрофония: сила мышц кисти, шеи, подвижность глаз и ЖЕЛ увеличиваются, а птоз, диплопия, дисфагия, нарушения на ЭМГ уменьшаются. При дыхательной недостаточности проба противопоказана.
1) Для более точной диагностики пробу проводят двойным слепым методом с плацебо — никотиновой кислотой (100 мг на 10 мл физиологического раствора), вызывающей общую реакцию, или физиологическим раствором. Часто добавляют атропин (0,4 мг) — как для дополнительного контроля, так и для подавления мускариновых побочных эффектов: потоотделения, слюноотделения, слезотечения, поноса, схваткообразных болей в животе, тошноты, непроизвольного мочеиспускания и дефекации, брадикардии, артериальной гипотонии, сужения зрачков (