что такое деградация белка
Деградация белков
Деградация белков – означает разложение белков. Этот процесс происходит в организме непрерывно и компенсируется синтезом белков в мышцах. После тренировки при условии достаточного количества аминокислот, получаемых из питания, соотношение процессов разложения и синтеза в организме имеет позитивный характер.
Это означает преобладание синтеза белков и, как следствие, рост количества белков в организме и увеличение объема мышечной массы. Если организм не получает из продуктов питания достаточное количество белков, соотношение процессов синтеза и распада в организме имеет негативный характер. Это приводит к атрофии мышечной массы. Из всего этого следует необходимость ежедневного потребления достаточного количества белков, особенно при силовых тренировках и иной двигательной активности.
Протеолитическая деградация белков в клетке
Переставшие быть необходимыми, белки подвергаются протеолитической деградации.
Долгое время считали, что вышеупомянутому протеолизу подвергаются лишь белки, локализованные в цитоплазме, допускали возможность протеолиза ядерных белков. Сейчас ясно: система работает также в отношении белков, связанных с мембранами, секретируемых белков (для этого последние должны переместиться из эндоплазматического ретикулума в цитозоль путём обратного транспорта).
Система внутриклеточного протеолиза вовлечена в такие процессы как пролиферация клеток, развитие и дифференцировка, реакция на стресс и патогены, репарация ДНК. Нарушения этой сложной системы являются причиной многих заболеваний.
Стадии убиквитин-зависимого протеолиза
Деградация белка по убиквитиновому пути включает две основные стадии :
1. Ковалентное присоединение к подлежащему деградации белку полиубиквитиновой цепи.
2. Деградация белка 26S протеосомой.
Деградация белков, ассоциированных с мембраной
Процессирование белков, ассоциированных с мембраной, отличается от деградации цитоплазматических белков. Не вдаваясь в детали этого процесса, обсудим основные отличия :
1. Деградация осуществляется лизосомами.
2. Для таргетинга белка в лизосомы обычно достаточно моноубиквитинирования. В некоторых случаях формируется полиубиквитиновая цепь.
3. В случае формирования полиубиквитиновой цепи связывание происходит по 63 лизину.
Биологический смысл убиквитинирования
1. В строго определённый момент подвергать специфическому протеолизу огромное количество разнообразных белков.
2. Отменять деградацию, если белок всё ещё нужен клетке.
Голодные химеры: направленный протеолиз в качестве лекарства
Молекула PROTAC одновременно связывает мишень и убиквитинлигазу, которая помечает ее для деградации в протеасоме. Рисунок в полном размере.
Автор
Редакторы
Большинство таргетных препаратов направлено на предотвращение работы белка-мишени путем ингибирования. Новый класс препаратов работает совершенно по другому принципу: он использует клеточную систему деградации белка для того, чтобы уничтожить мишень. PROTAC — протеолиз-таргетированная химера — как мостик связывает белок-мишень с убиквитинлигазой, которая метит его для деградации. Этот класс препаратов открывает новые принципы работы лекарств и мишени, доселе неизвестные. В этой статье спецпроекта о современных лекарствах рассказывается история создания PROTAC’ов и их современное состояние.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.
Партнер спецпроекта — компания Cytiva — образовалась в результате продажи подразделения GE Healthcare Biopharma корпорации Danaher Corporation. Cytiva — глобальный поставщик технологий и услуг, которые продвигают и ускоряют разработку и производство терапевтических средств. У компании богатое наследие, насчитывающее сотни лет. Клиенты Cytiva проводят мероприятия по спасению жизни, начиная от фундаментальных биологических исследований и заканчивая разработкой инновационных вакцин, биологических препаратов и новейших клеточных и генных терапий. Задача компании — предоставить инструменты и услуги, которые им необходимы, чтобы они работали лучше, быстрее и безопаснее, что приведет к лучшим результатам для пациентов.
В 1970-х годах в изучении онкологических заболеваний произошел переворот. В 1970 году Питер Фогт и Питер Дюсберг обнаружили трансформирующий фактор вируса саркомы Рауса [1], позже названный v-src. В 1976 году Гарольд Вармус и Майкл Бишоп обнаружили, что в клетках человека есть аналог вирусного src, клеточный ген с-src, который, как оказалось позже, кодирует тирозинкиназу. В последующие годы были идентифицированы и другие онкогены и опухолевые супрессоры: гены, которые контролируют опухолевую трансформацию и прогрессию.
Теперь у исследователей-онкологов появились мишени для направленной терапии и надежда, что можно отойти от токсичных препаратов, которые были единственным доступным средством химиотерапии (в рамка нашего спецпроекта выходила статья о поиске мишеней [2]). В 1980-х годах были предприняты первые попытки ингибировать продукты онкогенов с помощью мышиных антител [3], но такие препараты оказались малоэффективными и вызывали иммунную реакцию. В начале 1990-х случился прорыв [4]: практически одновременно были созданы и одобрены первый киназный ингибитор — иматиниб («Гливек») [5] — и первое антитело — трастузумаб («Герцептин»).
За этим последовал бум ингибиторов киназ и терапевтических антител, в результате которого создали препараты против множества релевантных киназ и поверхностных белков. Однако многие из идентифицированных онкогенов не являются киназами, или даже не обладают ферментативной активностью. Поэтому у них просто нет активного центра, который можно заблокировать низкомолекулярным веществом. Для того чтобы на них воздействовать, приходится использовать сравнительно большие молекулы — ингибиторы белок-белковых взаимодействий (PPI inhibitors), — часто требующие многих сложных методов для подтверждения правильного связывания с мишенью (рентгеноструктурного анализа комплекса, ЯМР и других [6]). Иногда такие мишени оказывались undruggable, то есть не поддающимися воздействию лекарствами.
Жизнь белков внутри клетки сложна и сурова. Как быть, если тебе вручили «черную метку»? На «Биомолекуле» уже немало было сказано про природу этой метки (белка убиквитина): «Вездесущий убиквитин» [8], «“Вездесущий убиквитин” возвращается» [9]; а недавно вышел обзор про протеостаз, передающий весь масштаб жизни и смерти белков: «Война и мир: как устроить белковую жизнь?» [10].
Протеасома
Протеасомную систему деградации открыли в 1970-х годах в лабораториях Аврама Гершко в Хайфе и Ирвина Роуза в Филадельфии. До этих исследований считалось, что белки могут деградировать только неспецифично в лизосомах, без затрат АТФ, несмотря на ряд работ (например Симпсона в 1953-м [11]), показывающих энергозависимую деградацию белков внутри клетки. Гершко и его аспирант Аарон Чехановер обнаружили, что деградация белков осуществляется двумя белковыми комплексами, один из которых деградирует белки (протеасома), а второй помечает их специальными метками, позже идентифицированными как полимеры белка убиквитина [8], направляя их на деградацию. В результате работ этой группы, лаборатории Александра Варшавского и ряда других в 1980-х была полностью идентифицирована система протеасомной деградации.
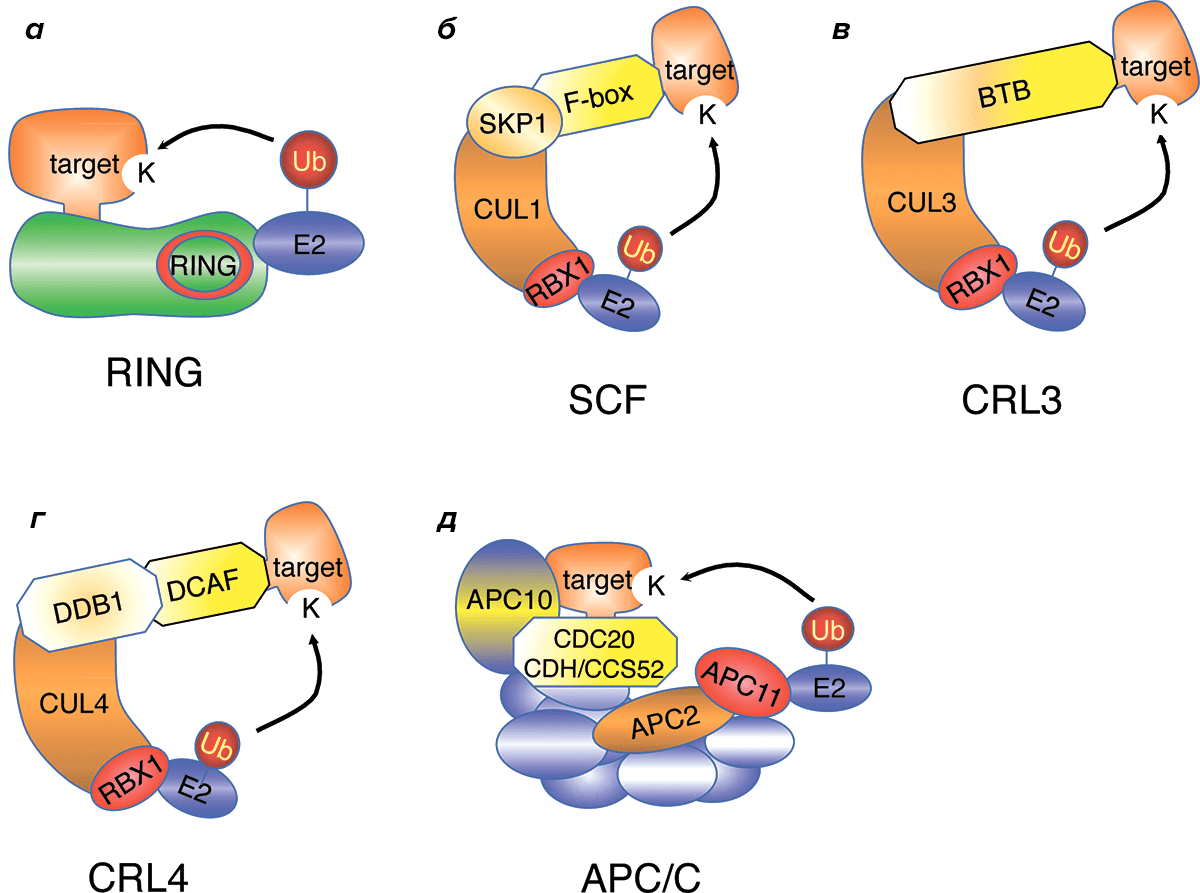
Ключевой частью системы протеасомы выступают ферменты, помечающие белки полиубиквитином. Существуют три группы ферментов, участвующие в этом процессе. E1-ферменты активируют убиквитин и переносят его на убиквитинконъюгирующий фермент E2. Наиболее многочисленны белки E3, которые обеспечивают специфичное связывание комплекса E2 с мишенью для деградации и переносят на нее убиквитиновую метку. Именно их разнообразие позволяет очень точно регулировать время полужизни каждого белка в клетке (рис. 1) [12].
Рисунок 1. Разные классы убиквитинлигаз, вовлеченные в регуляцию клеточного цикла. Мономерные RING-лигазы (а) напрямую связывают убиквитинконъюгирующий фермент E2 и мишень, в то время как SCF/CRL1, CRL3, и CRL4 (б–г) состоят из комплекса скаффолдных белков и RING-белка RBX1. APC/C (д) является огромным мультимерным комплексом, в который входят активирующие белки WD40, RING-доменный белок APC11 и другие.
История PROTAC
В 2001 году группы Реймонда Дешейза и Крейга Крюза придумали, как «натравить» систему протеасомной деградации на новые субстраты. Для этого они создали химерный пептид, состоящий из двух частей:
Получившаяся молекула работала как мостик, который связывал убиквитинлигазу E3 с ее новой мишенью. Исследователи увидели, что молекула не только физически сближает SCFβ-TRCP с новой мишенью, но и обеспечивает ее полиубиквитинилирование, а затем деградацию. Две особенности получившейся молекулы особо ценны:
Статья с описанием работы вышла в PNAS в 2001 году [7], и получившийся класс молекул окрестили PROTAC — proteolysis targeting chimera, или протеолиз-таргетированная химера. Авторы сразу предположили, что PROTAC можно использовать для терапии заболеваний, деградируя белки, участвующие в патогенезе, а также что можно деградировать белки только в определенных клетках и тканях, направляя к ним убиквитинлигазы, которые не синтезируются во всем организме. Однако они также отметили большое ограничение получившейся молекулы — пептидная конструкция не проникает в клетки сама собой.
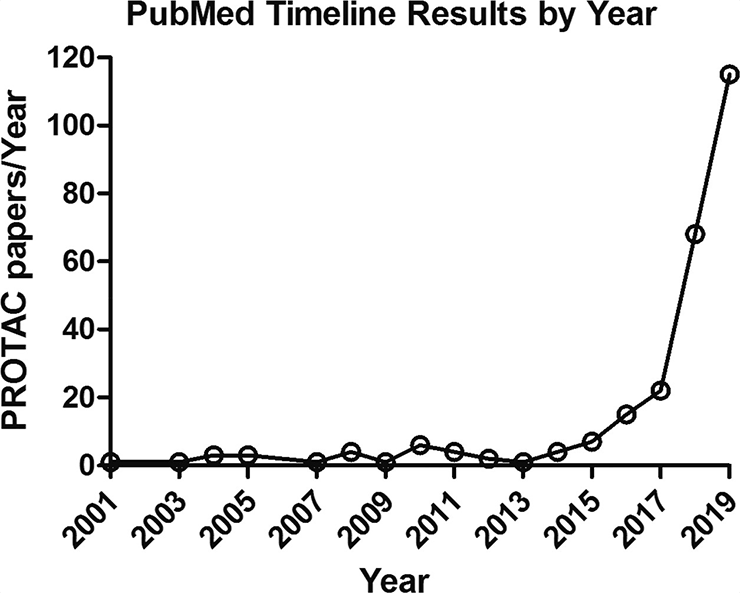
Рисунок 2. Динамика публикаций о PROTAC в Pubmed
Интерес к PROTAC был довольно скромным до 2015 года (рис. 2), однако затем область взорвалась десятками и сотнями статей [13]. Но для этого надо было решить проблему с доставкой в клетку и найти больше молекул, которые могут связывать E3-лигазы. Первый PROTAC, который мог проходить в клетку, был сделан той же парой Дешейза и Крюза, которые использовали пептид из транскрипционного фактора HIF-1α, субстрата E3-убиквитинлигазы VHL, помеченный поли-D-аргинином для проникновения в клетку. Полученный пептид мог направлять андрогеновый рецептор и белок FKBP12 на деградацию.
В лаборатории Крюза решили отойти от использования пептидов, и к 2008 году им удалось создать малую молекулу, которая позволяла деградировать андрогеновый рецептор [14]. Для этого они использовали селективный модулятор андрогеновых рецепторов (SARM), который эффективно связывался с рецептором. Второй частью молекулы был нутлин-3 — вещество, которое разрывало связь p53 c его убиквитинлигазой MDM2, связываясь с последней (рис. 3). Две части соединили ПЭГ-линкером, и получившаяся молекула работала внутри клетки, хотя и с не очень высокой активностью.
Вторым классом E3-лигаз, для которого были найдены низкомолекулярные ингибиторы, стали белки ингибиторы апоптоза IAP и XIAP, у которых также есть убиквитинлигазная активность. Ингибиторы этих белков разрабатывались как антиапоптотические белки, однако их конъюгация с мишенями позволила получить эффективные деградирующие химеры (названные SNIPER [15]).
Коммерциализация и начало клинических испытаний
Молекулы, связывающие убиквитинлигазу VHL, также находились в разработке, и в 2012 году в лаборатории Крюза создали первую малую молекулу, которая могла связывать VHL. В том же 2012 году Крюз основал Arvinas — первую компанию, которая планировала использовать PROTAC в клинике.
Вещества, привлекающие E3-лигазы VHL и CRBN, стали самыми популярными платформами для разработки низкомолекулярных PROTAC. В течение нескольких лет, начиная с 2015 года, были получены PROTAC против эстрогенового рецептора, BCR-ABL, Brd4, разнообразных рецепторных тирозинкиназ и множества других онкологических мишеней. К 2021 году количество описанных PROTAC-молекул увеличилось до 1600, а число мишеней — до 100.
В 2015 году были основаны две другие компании, решившие сделать ставку на использование PROTAC: Kymera Therapeutics и C4 Therapeutics. Рост числа, разнообразия и активности PROTAC привлек внимание крупных фармацевтических компаний: Arvinas заключил партнерские соглашения с Merck и Genentech, C4 — с Roche, а Kymera — с Sanofi.
В 2019 году Arvinas начала первые клинические испытания PROTAC-молекулы ARV110, направленной против того же андрогенового рецептора, в том числе и с мутациями, устойчивыми к имеющимся ингибиторам этого рецептора (например энзалутамиду). Для того чтобы PROTAC достигли клиники, пришлось решить множество проблем с биодоступностью, стабильностью и другими параметрами. Огромные молекулы PROTAC нарушали множество устоявшихся правил медицинской химии (такие как правило пяти Липинского), вначале вызывая ужас технологов и сомнения в том, что эти молекулы могут реально работать в организме. Однако все эти проблемы были решены, и к концу 2021 года количество клинических испытаний PROTAC должно увеличиться до 15 [18].
Среди мишеней PROTAC множество популярных онкологических мишеней: упомянутый выше эстрогеновый и андрогеновый рецепторы; эпигенетические белки BRD4 и BRD9, которые считывают гистоновые метки [19]; транскрипционный фактор STAT3 и другие. Один из клинических кандидатов — DT2216, деградирующий антиапоптотический белок Bcl-xL, — иллюстрирует сильные стороны PROTAC по сравнению с обычными ингибиторами: в свое время разработка ингибиторов Bcl-xL приостановилась из-за того, что тромбоциты гибнут при инактивации Bcl-xL. Решение, ставшее возможным с использованием подхода PROTAC, основано на том, что DT2216 таргетирует этот белок к убиквитинлигазе VHL, которая не производится в тромбоцитах.
У молекул PROTAC обнаружились и неожиданные преимущества — они оказались гораздо активнее, чем простые ингибиторы тех же молекул, работая скорее как катализаторы деградации: после того, как мишень деградировала в протеасоме, PROTAC освобождается для нового раунда связывания. Еще одно преимущество — PROTAС, убирая сам белок (а не только его активность), часто влияют на неферментативные функции своих мишеней, например, на стабилизацию комплексов, в которые они входят. Так, опухолевые линии, не чувствительные к ингибиторам BRD9, оказались очень чувствительными к его деградации.
Кроме онкологических, PROTAC разрабатываются и для других заболеваний. В Kymera сосредоточены на мишенях, важных не только для опухолей, но и для иммунной системы, таких как IRAK4 и вышеупомянутый STAT3. У Arvinas есть ряд молекул, направленных на нейродегенеративные заболевания — в разработке находятся молекулы, деградирующие хантингтин, ɑ-синуклеин и тау-белок. В 2019 году вышло несколько работ, показывающих эффективность тау-направленных PROTAC на животных моделях болезни Альцгеймера [20].
К сожалению, первые результаты клинических испытаний ARV110 немного охладили энтузиазм по поводу PROTAC: несмотря на очень впечатляющие результаты в мышиной модели, лишь у двоих из 22 пациентов наблюдалось значительное сокращение объема опухоли, и у части пациентов — отсутствие дальнейшего прогрессирования заболевания. Однако больше половины пациентов (которые прошли множество предыдущих линий терапии) продолжают получать терапию, и окончательные результаты испытания еще не представлены. Другой претензией скептиков PROTAC является то, что для большинства мишеней, против которых показана активность, уже имеются обычные ингибиторы. Пока обещания найти PROTAC для белков, недоступных для «обычных» ингибиторов, остаются невыполненными.
Другие бифункциональные молекулы
Способность молекул PROTAC привлекать к мишени белок, который ранее с ней не связывался, вызвала интерес — можно ли нацеливать другие ферменты на белки-мишени. Прежде всего были получены молекулы, направляющие мишени на другие пути деградации.
Lysosomal-targeting chimera (LYTAC) и MoDE-A являются модифицированными антителами, которые связывают мишень вне клетки и затем поглощаются эндоцитозом, связываясь с рецепторами (CI-M6PR и ASGPR) через линкерную молекулу. Поглощенный таким образом комплекс из антитела и белка-мишени направляется в лизосому.
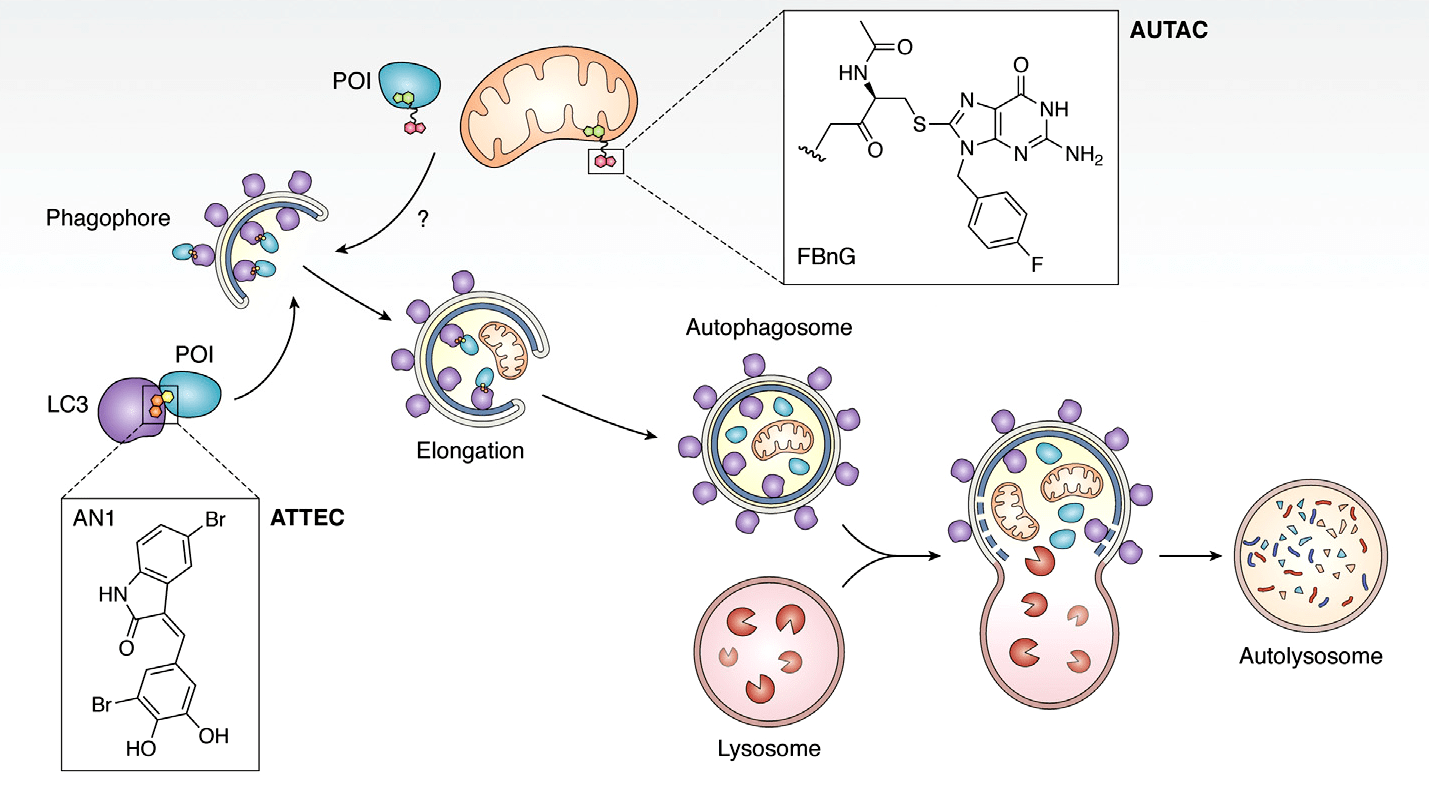
MADTAC-молекулы (macroautophagy degradation targeting chimeras, химера для направленной деградации макроаутофагией) используют еще один путь для деградации — аутофагию [21], [22]: ATTEC-молекулы (autophagosome-tethering compound, соединение, связывающее аутофагосомы) связывают мишень с LC3, компонентом мембраны аутофагосомы, в то время как AUTAC (autophagy-targeting chimera, химера для направленной аутофагии) направляют мишень в аутофагосому с помощью гуаниновой метки по неизвестному механизму [23]. AUTAC-молекулы могут помечать даже целые органеллы (например поврежденные митохондрии) для деградации (рис. 4).
Рисунок 4. Механизмы действия MADTAC (macroautophagy degradation targeting chimeras). ATTEC связывает белок-мишень и компонент аутофагосомы LC3. AUTAC-молекулы содержат гуаниновую метку, которая помечает мишень (в том числе целые органеллы) для включения в аутофагосому.
В 2019 году исследователи из Genentech сделали бифункциональную молекулу, привлекающую фосфатазу к мишени. Получившийся класс назвали PhoRC [24]. Обратный процесс позволяет направить киназы для фосфорилирования новых мишеней (эти вещества названы PHIC [25]). РНК-связывающие лиганды можно совместить с молекулой, привлекающей РНКазу L, получив RIBOTAC [26], [27]. Многие из этих молекул выглядят скорее как научные игрушки, чем клинические кандидаты, но и сами PROTAC вначале не казались похожими на реальные лекарственные молекулы.
Заключение
PROTAC представляет собой одну из удивительных историй успеха современной фармакологии. Всего за 20 лет эти вещества прошли от первоначальной идеи до множества реальных клинических кандидатов. PROTAC создал новую парадигму в медицинской химии, открыв новые принципы воздействия на мишень и существенно расширив горизонты возможного для низкомолекулярных соединений, связанные не только с ингибированием ферментов. И хотя нельзя предсказать, насколько эти молекулы будут клинически эффективны, в ближайшие годы их явно ждет большое будущее.
Партнер спецпроекта — компания Cytiva
1 апреля 2020 г. в результате приобретения подразделения GE Healthcare за 21,4 млрд долларов компанией Danaher Corporation была создана компания Cytiva. Cytiva аккумулировала в себе наследие передовых инноваций и разработок в таких областях, как очистка белка, одноразовые технологии, а также клеточная и генная терапии.
Ведущими брендами Cytiva являются: ÄKTA, Amersham, Biacore, FlexFactory, HyClone, KUBio, MabSelect, Whatman, Xuri, Xcellerex.
Компания Cytiva — номер один в очистке антител.
Cytiva оперирует в 40 странах и регионах, охватывая Европу, Азию, Северную и Латинскую Америки, а также Ближний Восток. Тысячи сотрудников занимаются развитием и ускорением разработки и производства терапевтических препаратов.
Во всем мире используется 100 000 систем компании Cytiva, а также более 60 установок технологических платформ «ФлексФактори».
Cytiva имеет 15 производственных площадок, 11 клиентоориентированных объектов, которые помогут масштабировать процесс от идеи до коммерческого производства, 7 глобальных складов, а также 6 учебных центров.
Ви́дение Cytiva — это мир, в котором доступ к жизненно важным методам лечения трансформирует здоровье человека. Являясь надежным партнером для клиентов различных масштабов и уровней, компания Cytiva повышает эффективность исследований и производственных процессов, обеспечивая разработку, производство и поставку революционных и инновационных препаратов для пациентов.
С использованием технологий Cytiva производится 75% утвержденных FDA биофармпрепаратов.
Посетите наш сайт www.cytivalifesciences.com для получения дополнительной информации.
Материал предоставлен партнёром — компанией Cytiva
Белки попадают в протеасому через «преддверие» уже развернутыми
Протеасома — это белковый комплекс, который занимается в клетке избирательной деградацией белков. Хотя протеасома подробно исследовалась с конца 1970-х годов (и за это даже была присуждена Нобелевская премия по химии 2004 года), в ее работе по-прежнему полно загадок и белых пятен. Например, не до конца изучен вопрос о том, как и где «разматывается» белок, входящий в протеасому, и как именно ей удается удержать белок раскрученным. Статья, опубликованная недавно в журнале Nature, дает ответы на эти вопросы.
В цитоплазме клетки плавает множество белков, и их состав постоянно обновляется — с рибосом сходят «новорожденные» белки, а «состарившиеся», поврежденные и неверно сложенные подвергаются расщеплению (о том, как складываются белки, см.: Помогать науке можно играя, «Элементы», 01.09.2010; о том, какой вред могут нанести клетке неверно сложенные белки, см.: Нейрофибриллярные клубки при болезни Альцгеймера — не убийцы, а защитники клеток?, «Элементы», 15.05.2010).
Уничтожение «неугодных» белков происходит двумя путями. Во-первых, белок может быть проглочен лизосомой (она уничтожает белки не очень избирательно; кроме того, лизосомы — это всё-таки органеллы, они слишком крупные, чтобы встречаться в каждом клеточном «закоулке» и обеспечивать повсеместную потребность клетки в деградации белков). Во-вторых, белок может быть пойман протеасомой (см. также Proteasome), о чём мы сейчас и поговорим.
Протеасома — гигантский (с молекулярной массой около 2000 килодальтон) белковый комплекс. Классическая протеасома состоит из одной центральной частицы (ее коэффициент седиментации — см. седиментационный анализ — составляет 20S, и так — 20S — ее обычно и называют), в которой происходит расщепление белка, и двух регуляторных (19S), расположенных от нее с двух сторон. 19S-частицы распознают субстрат и отправляют его «в пасть» 20S.
Протеасома не занимается разбоем и не уничтожает первые встречные белки. Ее жертвы должны быть помечены «черной меткой» — цепочкой из не менее четырех маленьких белков убиквитинов (кстати, появляются данные о том, что роль убиквитина не всегда столь «убийственна», см. статью «Вездесущий убиквитин»). «Пришивание» убиквитина к обреченному белку происходит в несколько стадий с помощью трех видов ферментов. Именно убиквитиновую цепочку и распознают 19S-частицы, после чего отправляют «смертника» «на эшафот».
20S-частицы состоят из четырех сложенных в стопку колец, каждое из которых, в свою очередь, образовано семью субъединицами. Каждое наружное кольцо образовано семью альфа-субъединицами (α7); они служат местом прикрепления для 19S-частиц и «дверью», в которую входит обреченный белок. Каждое внутреннее кольцо образовано семью бета-субъединицами (β7), и именно в них и происходит расщепление белков. В 20S-частице есть три полости — одна центральная, каталитическая, в которой расщепляются белки, и два «преддверия», где белки томятся перед тем, как «взойти на эшафот».
Простая логика подсказывает, что, прежде чем разрезать на куски запутанную белковую цепочку, ее надо распутать, хотя бы частично. Очевидно, белки начинают разворачиваться в 19S-частице протеасомы, потому что у 20S-частицы отверстие очень узкое, всего 13 Å, и свернутый белок в него просто не пролезет. Но вот что происходит с белком в «преддверии» и в каком он там находится состоянии, пока что не было достоверно известно.»
Чтобы изучить работу преддверной полости более подробно и выпукло, исследователи взяли для экспериментов сразу три белка, как можно более непохожие друг на друга по типу складывания, заряду и т. д. Белки эти (если быть точным, это были не целые белки, а только белковые фрагменты, с которыми просто удобней было работать) назывались EnHD, FynSH3 и Pin1WW. Все они, будучи оставленными в растворе наедине с 20S-субъединицей, легко подвергались расщеплению.
Основная часть исследований проводилась не на целом комплексе (его размер уже накладывает ограничения у метода спектроскопии — например, невозможно становится работать в большом диапазоне температур), а на двух α7 кольцах, которые спонтанно соединяются в растворе, если там нет β7 колец. В α7α7 возникает примерно такая же полость, как и преддверная, а работать с ним гораздо легче. К тому же, самые важные результаты исследователи подтвердили на целом α7β7β7α7-комплексе.
На той поверхности α7-кольца, которая обращена в сторону полости, ученые выбрали три точки, к которым «пришивали» N-конец белка (эти точки на рисунке указаны как V129, S95 и R115). «Родная» аминокислота в каждом из этих участков была заменена на цистеин, к которому с помощью специального реагента можно было теперь пришивать белковую цепочку. Белок оставался связанным с полостью до тех пор, пока в раствор не добавляли высвобождающий его агент.
Спектры белков, находящихся внутри полости, были совершенно не похожи на спектры этих белков, когда они, правильно сложенные, свободно плавали в растворе. Скорее они напоминали спектры белков в денатурированном (то есть полностью развернутом) состоянии. А это означает, что наша полость — это и есть то место, где белки «разматываются» до аминокислотной цепочки.
Стоит отметить, что к какому бы из трех возможных мест внутри полости мы ни прикрепляли наши белки, их спектры менялись очень мало, что говорит о том, что конкретное местоположение белка в полости не имеет большого значения — где бы он ни оказался, он всё равно будет развернут.
Теперь предстояло узнать, меняется ли сама полость (и если меняется, то насколько), когда в нее попадает субстрат. Оказалось, что изменения эти незначительны: комплекс разворачивает белки, практически «не двигаясь», без помощи энергичных конформационных перестроек.
Еще один интересный момент — то, что при разных температурах комплекс работал по-разному. Один из трех наших белков — EnHD — разворачивался в полости даже при 25°С, остальные же при этой температуре пребывали в состоянии, близком к свернутому, а развернуться могли только при более высокой температуре. Видимо, это связано с тем, насколько трудно распутать ту или иную структуру — EnHD, например, свернут в альфа-спираль, а FynSH3 и Pin1WW имеют бета-конформацию.
Итак, какие же выводы мы можем сделать из полученных данных? Судя по всему, дело обстоит так. Белок (состоящий из множества аминокислот, каждая из которых обладает какими-либо свойствами — гидрофильностью, гидрофобностью, электрическим зарядом) попадает в полость преддверия протеасомы. Полость эта тоже выстлана разнообразными аминокислотами и группами аминокислот, которые притягивают соответствующие аминокислоты белка (например, положительно заряженные притягивают отрицательно заряженные, и наоборот). В результате белок растягивается, теряет свою первоначальную конформацию и разворачивается в цепочку. И эта развернутая цепочка отправляется в центральную каталитическую полость протеасомы, где будет разрезана на куски.
Источник: Amy M. Ruschak, Tomasz L. Religa, Sarah Breuer, Susanne Witt, Lewis E. Kay. The proteasome antechamber maintains substrates in an unfolded state // Nature. 2010. V. 467. P. 868–871.