что такое болезнь кенига коленного сустава лечение
Некроз коленного сустава
Специалисты ЦМРТ более 15 лет специализируются на диагностике и лечении заболеваний суставов. Читайте подробнее на странице Лечение суставов.
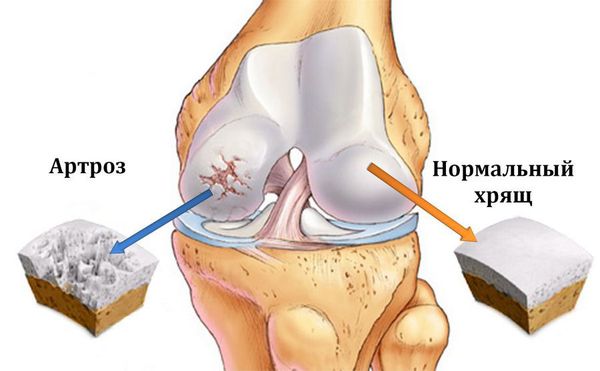
Остеонекроз коленного сустава – это поражение костной ткани в результате нарушения кровоснабжения, приводящее к гибели костных клеток.
Рассказывает специалист ЦМРТ
Дата публикации: 09 Июля 2021 года
Дата проверки: 19 Июля 2021 года
Содержание статьи
Причины остеонекроза
Первичный идиопатический асептический некроз коленного сустава, причины которого остаются невыясненными.
Вторичный остеоартроз, в развитии которого играют роль следующие факторы:
Симптомы
Стадии развития
По рентгенологическим признакам различают 5 стадий развития асептического некроза коленного сустава:
Как диагностировать
Для дифференциальной диагностики с другими патологиями опорно-двигательного аппарата делается общий и биохимический анализ крови.
Метод рентгенодиагностики на начальных стадиях некроза костей колена метод малоинформативен. Изменения на рентгенограммах: увеличение плотности костной ткани, микропереломы, сужение суставной щели появляются только на последних стадиях асептического некроза.
МРТ при асептическом некрозе коленного сустава выявляет дезорганизацию структуры, плотности костного вещества, минимальные очаги некроза еще при отсутствии клинической симптоматики.
Сцинтиграфия рекомендуется для дифференциальной диагностики некроза коленного сустава 3 степени с онкологией.
К какому врачу обратиться
Диагностикой и лечением заболеваний опорно-двигательного аппарата, в том числе и асептического некроза коленного сустава, занимается врач-ортопед.
Реабилитация колена после рассекающего остеохондрита
Реабилитация колена после рассекающего остеохондрита
Описание реабилитации. Методика и сроки восстановления.
Рассекающий остеохондрит — заболевание, заключающееся в отделении небольшого участка хряща от прилежащей кости со смещением его в полость сустава. Заболевание носит имя его открывателя, Кенига. Встречается достаточно редко, тем не менее, требует пристального внимания, так как нелеченные формы часто приводят к инвалидизации больного. Рассекающий остеохондрит коленного сустава приводит к артриту, причем достаточно быстро. Последний с не меньшей скоростью прогрессирования перерастает в артроз со всеми характерными для него последствиями.
Для того чтобы не допустить появления тяжелых осложнений, а болезнь не редко развивается в молодом возрасте, требуется грамотное лечение и реабилитация рассекающего остеохондрита коленного сустава. Как правило, все лечебные манипуляции не просто затягиваются, а требуют пожизненного контроля, от болезни едва ли получиться избавиться наверняка, но поддерживать себя в здоровом физиологическом состоянии — по силам каждому.
Подробнее о восстановлении колена после рассекающего остеохондрита
Реабилитация рассекающего остеохондрита, болезни Кенига нередко повторяет принципы воспалительных процессов в колене, сначала задача врачей заключается в купировании острой фазы болезни, перевода ее в ремиссию. Нередко пациенты обращаются с уже имеющимися осложнениями, а также другими сопутствующими заболеваниями, сильно утяжеляющими лечение и реабилитацию. Конечно, пациент не всегда виноват в этом, так как лишний раз бояться обращаться к врачу, это в некотором плане стало для общества нормой, с которой ничего не поделаешь. реабилитация болезни Кенига также требует лечебной физкультуры, сезонных физиопроцедур и курсов массажей. В целом при правильном подходе прогноз относительно благоприятный.
Сроки реабилитации зависят от характера смещения хращя, его размера, состояния сустава и в целом период восстановления может занимать от 6 месяцев и более. Конечно во внимание следует принять и возраст пациента, его пол и общее физическое состояние.
В реабилитации при диагнозе «рассекающий остеохондрит» особое внимание следует уделить снятию воспаления, и это достигается с помощью курса физиопроцедур.
Конечно сразу назначается лечебная физкультура, которая начинается с изометрических упражнений, затем, по мере улучшения состояния колена, добавляются специальные упражнения на укрепление связочного аппарата сустава с целью уменьшения нагрузки на надколенник.
По мере необходимости врач может назначить массаж и ЛФК в воде.
Что такое остеоартроз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Фомичев А. А., травматолога со стажем в 8 лет.
Определение болезни. Причины заболевания
Остеоартроз (артроз) — заболевание суставов, характеризующееся дегенеративным изменением покрывающего кость хряща, проще говоря, его разрушением.
Подавляющее число поражаемых суставов — это коленный, тазобедренный, плечевой и первый плюсне-фаланговый. Поражение других суставов встречается намного реже и часто является вторичным. Остеоартроз поражает 12% трудоспособного населения только европейской части Российской Федерации, причем в последние годы вызванная им нетрудоспособность выросла в 2 раза. [1]
Как и у любого заболевания, у остеоартроза также имеются факторы риска его развития, которые и сегодня активно изучаются, и список ежегодно расширяется. [5] Основными принято считать:
— нарушения обмена веществ;
— повышенный вес тела;
— неполноценное и нерегулярное питание;
— артрит (воспалительный процесс в суставе);
— очаги хронической инфекции или воспаления (например, хронический тонзиллит).
— варикозное расширение вен нижних конечностей.
Симптомы остеоартроза
Общие симптомы артроза включают:
Суставная боль редко бывает острой, чаще ноющего или тупого характера, как правило, прекращающаяся во время покоя. Симптомы часто носят волнообразный характер, могут возникать и прекращаться без попыток лечения. Они могут быть незначительными, умеренными или тяжелыми. Жалобы при остеоартрозе могут оставаться примерно одинаковыми в течение многих лет, но со временем прогрессируют, и состояние ухудшается. Незначительные и умеренные симптомы возможно контролировать на одном уровне, а вот тяжелое течение заболевания может привести к хронической боли, неспособности выполнять ежедневные бытовые действия, что влечет за собой и потерю трудоспособности, вплоть до инвалидизации.
Патогенез остеоартроза
Классификация и стадии развития остеоартроза
Разделяют заболевание на 2 большие группы: первичный (или идиопатический) и вторичный. Первая группа развивается в результате либо неясной причины, либо в результате возрастных изменений. Вторая характеризуется четкими причинами и развивается в результате их патологического процесса (например, на фоне туберкулеза, рассекающего остеохондрита, субхондрального некроза и т.д.)
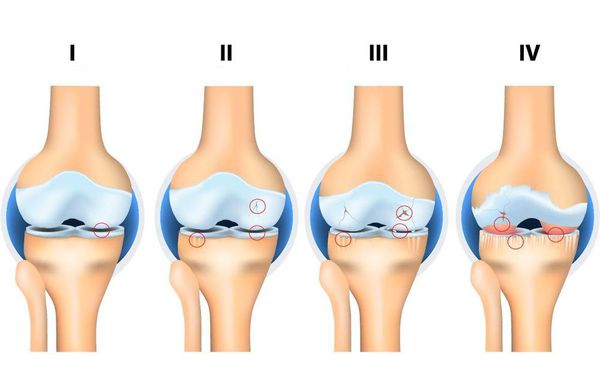
Независимо от причин, которые явились фактором развития остеоартроза, различаются 4 стадии его развития:
1 стадия: твердые структуры сустава в процесс разрушения не вовлекаются, имеются начальные изменения в его мягких структурах и в составе суставной жидкости (которая является питательной средой и снижающей трение сустава), происходит нарушение питания сустава.
2 стадия: сопровождается «запуском» механизма разрушения твердых структур сустава, образуются краевые твердые образования (экзостозы, остеофиты). Умеренные жалобы на изменения в объеме движений.
3 стадия: сопровождается сужением суставного просвета, выраженным разрушением нагружаемой поверхности с образованием костно-хрящевых дефектов, выраженным ограничением движений, постоянным чувством «хруста» при движении, начальными изменениями оси конечности.
4 стадия: тяжелая, при которой движения выраженно ограничены в суставе вплоть до полного его отсутствия (анкилоз), выраженным воспалительным процессом, его деформацией, образованием костных дефектов (в результате полного отсутствия хрящевого покрова).
Осложнения остеоартроза
Без лечения любое заболевание дает осложнения, и артроз не исключение. Если это первичная форма, то к основным осложнениям относятся:
Если это вторичная форма, то осложнения зависят от процесса, вызвавшего развитие артроза. Например, это может привести к остеопорозу, хроническому заболеванию, которое характеризуется прогрессирующим нарушением обмена веществ в костной ткани. Вследствие этого кости становятся хрупкими, нарушается их питание, в итоге остеоартроз осложняется угрозой внутрисуставных переломов. Поэтому так важно обратиться к врачу своевременно. Как писал выдающийся русский хирург Н.И.Пирогов: «Будущее принадлежит медицине профилактической».
Диагностика остеоартроза
Диагностика артроза часто начинается с врача (как правило, это травматолог-ортопед) медицинской помощи первого звена (поликлиники), где выполняется клинический осмотр и интерпретируются данные обследования (КТ, МРТ, рентгенограммы и т.п.), чтобы определить степень и тип остеоартроза. Диагностика и постановка диагноза обычно не вызывают затруднений. Если диагноз неясен или врач предполагает вторичное развитие заболевания, то для уточнения пациент направляется к врачам других специальностей (например, ревматологу). Поставить степень артроза без результатов обследования очень затруднительно. Важным для постановки диагноза и определения тактики лечения является также история заболевания, способы и попытки лечения, так как перед врачом часто стоит сложная задача дифференциальной диагностики (например, симптомы артроза и артрита часто совпадают).
Лечение остеоартроза
На начальных стадиях остеоартроз поддается консервативному лечению при условии комплексного подхода. Лечение требует длительного времени и преследует основную цель: либо остановить процесс разрушения на той стадии, на которой начато лечение, либо этот процесс замедлить. Комплекс включает в себя медикаментозное и немедикаментозное лечение, в который входят курсы ЛФК (лечебной физкультуры и гимнастика), физиотерапия (чаще это фонофорез и магнитотерапия), плавание, противовоспалительная терапия (либо прием внутрь, либо местно в виде гелей или крема), хондропротективной терапии (прием препаратов на основе хондроитина сульфата и глюкозамина) и внутрисуставных инъекций (это могут быть как гомеопатические препараты, так и препараты гиалуроновой кислоты). Хондропротекторы до сих пор применяются врачами-травматологами-ортопедами на территории РФ и СНГ, их назначают курсами внутрь, однако результаты последних научных исследований западных стран опровергают положительное действие в сравнении с эффектом плацебо. [2] При выраженных симптомах и тяжелых стадиях консервативное лечение становится неэффективным, что ставит на первое место лечение оперативное. Учитывая показания, это может быть как малоинвазивное лечение — артроскопия, так и эндопротезирование. При артроскопии (эндоскопии сустава) выполняется его санация под контролем видео-оптики, производится удаление экзостозов (при возможности) и повреждения мягких структур, что при таких стадиях наблюдается достаточно часто. Однако в последнее время пользу от такого вида вмешательства при остеоартрозе все чаще стали ставить под сомнение, так как оно не имеет должного эффекта при хронической боли, [3] а в ряде случаев и может нанести значительный вред при некачественном выполнении. [4]
Эндопротезирование – технически сложная и тяжелая операция, цель которой — создать искусственный, полностью новый сустав. Требует четких показаний и определения рисков при наличии противопоказаний. Сегодня успешно используются эндопротезы для коленного, тазобедренного и плечевого суставов. Дальнейшее амбулаторное наблюдение врачом снижает риски и сроки реабилитации, улучшает качество и эффективность выполненной операции.
Прогноз. Профилактика
Прогнозирование зависит от своевременного обращения к врачу-травматологу-ортопеду и начала комплекса лечения. В плане ликвидации морфологических изменений при остеоартрозе прогноз неблагоприятный, так как полностью восстановить хрящевую структуру сустава невозможно. В пожилом возрасте течение заболевания более тяжелое, чем в молодом. Однако при своевременном обращении к врачу и соблюдении всех рекомендаций можно добиться устранения всех жалоб и восстановить полноценную двигательную функцию сустава.
Разрыв мениска
Разрыв мениска – травма номер один по частоте возникновения среди всех повреждений коленных суставов. Врачи МЦ «Мирт» накопили огромный опыт в ее лечении и готовы помочь своим пациентам.
Мениски – амортизирующая система коленного сустава, выполняющая еще и стабилизирующую функцию. В коленях их два, расположены они по бокам сустава, соединены связкой спереди, своей формой напоминают полумесяцы. Один из них больше повернут кпереди, а второй – кзади. В медицине их принято называть латеральным (передним) и медиальным (задним) менисками соответственно.
Форма менисков определяет их строение, каждый можно зрительно разделить на три части:
Сосудистая сеть в них распределена неравномерно: выделяют красную, богатую капиллярами зону, которая находится на краю, и белую – полностью лишенную кровоснабжения. Она расположена в центре.
Скорость заживления травмированного мениска зависит от локализации травмы: быстрее и лучше восстанавливается «красная» зона хряща.
Разрыв мениска коленного сустава – следствие прямых, непрямых и косвенных травм колена или длительных дегенеративных изменений в тканях на фоне подагры, ревматизма, ускоренного износа суставов у людей, большую часть времени работающих стоя.
Встречаются и комбинированные травмы, при которых вместе с хрящом повреждаются другие части сустава – связки, капсула, жировое тело. Разрыв сустава мениска (название в корне неверное, но применяемое в обиходе несведущими в медицине людьми) – тяжелая травма, на лечение которой уходит очень много времени.
Для определения характера повреждений имеют значение ситуации, в которых они были получены.
Так, прямые травмы возникают при падении из-за резкого удара коленом о ребро бордюра или ступеньки или из-за столкновения с быстро движущимся предметом.
Непрямые и косвенные повреждения менисков – частая проблема спортсменов и танцоров – людей, которые для выполнения определенных элементов упражнений или танцев подолгу вращаются на одной ноге, много бегают, прыгают, ходят гуськом. Любители посидеть на корточках – тоже в группе риска по возникновению разрывов мениска.
С комбинированными повреждениями к травматологу обращаются пожилые люди с уже имеющимися возрастными или дегенеративными изменениями в тканях хрящей. У них наступает разрыв рога медиального мениска (задней части).
Разрыв медиального мениска и другие травмы: виды повреждений коленных хрящей
Латеральный (передний) хрящ страдает от травм сравнительно редко. Разрыв заднего мениска – лидер среди всех повреждений коленных хрящей: наблюдаются полный, неполный, поперечный и продольный, раздробленный разрыв, а также отрыв в форме лоскута.
При этом передний рог наименее подвержен травмированию, а чаще всего страдает само тело с переходом на один из рогов. Изолированный разрыв заднего рога медиального мениска встречается примерно в трети случаев.
Также врачи травматологи классифицируют повреждения хрящей по локализации и степени тяжести:
При травмах разорванная часть хряща может смещаться или оставаться статичной. Разрыв заднего – медиального – мениска во многих случаях отягощается повреждением других частей сустава – капсулы, жирового тела и связок, особенно у пожилых людей, уже имеющих проблемы с костным аппаратом.
Как диагностируют разрывы менисков
В остром периоде разрыв рога мениска или его тела диагностировать очень сложно, если нет возможности применить артроскопию – самый надежный способ отличить травму именно хряща от других повреждений колена. Причина – в большом сходстве их симптомов:
Полная картина травмы проявляется лишь спустя две-три недели после травмы, в так называемом подостром периоде, когда симптомы разрыва хряща «конкретизируются»:
Проводится и ряд озвученных тестов – специальных движений, при которых хорошо слышны характерные звуки скольжения менисков, их перемещения, а также щелчки.
Разрыв медиального хряща достоверно определяется по истинной блокаде сустава, когда он фиксируется под очень большим углом – примерно в 150 градусов. Однако и тут специалистам нужно быть начеку: даже такой красноречивый симптом может быть признаком лишь контрактуры мышц – следствия ушибов, травм капсулы и связок. Иногда он возникает на фоне хондромаляции, хондроматоза, болезней Кенига и Гоффы или вполне безобидного и легко устранимого ущемления крыловидной связки.
Диагностика травм менисков в МЦ «Мирт» давно не представляет собой особой сложности благодаря имеющейся в центре диагностической аппаратуре – современному видеоартроскопу, который помогает стопроцентно определить вид травмы, ее тяжесть и сразу провести лечение – быстрое и эффективное.
Разрыв мениска коленного сустава: лечение травмы
Врачебная тактика избирается в зависимости от того, какой характер имеет разрыв мениска: лечение может быть назначено как консервативное, так и хирургическое.
Консервативные методы чаще применяются при острой неосложненной травме:
Шинирование поврежденного колена с целью полного обездвиживания на две недели
Лечение разрыва мениска без операции оправданно при разрывах заднего рога, когда травма не очень сложна и есть возможность устранить блокаду сустава. Имеет значение и глубина разрыва: если медиальный диск разорван продольно не более чем на 10 мм, а поперечные разрывы снизу или сверху не превышают трех миллиметров, то такие травмы часто вообще заживают сами.
Прочным рубцом при своевременной и правильно назначенной консервативной терапии срастаются паракапсулярные разрывы благодаря хорошему кровообращению в прикапсулярной области.
Разрыв мениска коленного сустава: операция в МЦ «Мирт»
Хирургическое вмешательство неизбежно, когда врач диагностирует полный или глубокий разрыв мениска: операция в таких случаях – единственный способ сберечь коленный сустав. Не обойтись без нее и пациентам с хронической травмой хряща.
До появления артроскопии операция всегда означала полное удаление поврежденного хряща на открытом суставе, что в будущем влекло за собой долгий период восстановления и преждевременный износ.
Сейчас хирурги применяют щадящую методику сшивания поврежденных частей, которая позволяет сохранить мениск. Проводят они и артроскопическую менискэктомию, если хрящ полностью оторван, раздавлен или на нем появилось много кист.
Никакой подготовки к операции методом артроскопии не требуется: достаточно лишь обследования.
Операция на мениск проводится под одним из избранных анестезиологом видом обезболивания – местным или проводниковым. Далее бедро перетягивают жгутом и делают два разреза на коже травмированного колена: один – для артроскопа с видеокамерой, а второй – для введения специальных хирургических инструментов.
В ходе вмешательства врач оценивает состояние согнутого коленного сустава, наблюдая полученную картинку на мониторе, удаляет обломки, сшивает то, что можно сшить.
При менискэктомии хрящ удаляется полностью, а полость сустава санируется – из нее извлекают мелкие инородные тела, затем обрабатывают антисептиком.
После операции на больную ногу накладывают давящую повязку, холод. Пациент может вставать и ходить с опорой уже на следующий день и еще два-три дня наблюдается в отделении, после чего выписывается.
Потом еще несколько недель он передвигается с опорой и лечится амбулаторно тут же, в МЦ «Мирт», где его продолжают наблюдать наши специалисты.
В дальнейшем пациентам рекомендуются реабилитационные физиотерапевтические курсы, занятия ЛФК в спортзале клиники.
Современные аспекты лечения болезни Кенига у детей
Полный текст
Аннотация
Актуальность. Болезнь Кенига, или рассекающий остеохондрит коленного сустава, известен еще с конца XVI в. Встречается часто (18–30 случаев на 100 тыс. населения), при этом единых взглядов на тактику ведения и выбор метода лечения данной патологии нет. Неверно подобранное лечение, как и отсутствие активной тактики его ведения, приводит неизбежно первичную патологию в ранний деформирующий артроз с последующим выраженным снижением функции сустава и трудоспособности уже взрослого пациента.
Материалы и методы. Использованы открытые интернет-ресурсы: электронная научная библиотека PubMed, SciVerse (Science Direct), Scopus. Применены ключевые слова для поиска источников информации: рассекающий остеохондрит, болезнь Кенига, osteochondritis dissecans. В статье представлены основные результаты в публикациях отечественных и зарубежных специалистов с акцентом на проблемы диагностики и лечения рассекающего остеохондрита, изложены также собственные комментарии по патогенезу, диагностики и принципам лечения болезни.
Заключение. Задачами хирургического лечения болезни Кенига в детском возрасте являются: восстановление конгруэнтности суставных поверхностей путем улучшения васкуляризации зоны поражения, жесткая фиксация, сохранение нестабильного фрагмента и его защита опорной части нагружаемого отдела мыщелка в послеоперационном периоде. Вследствие отсутствия исследований с высоким уровнем доказательств, клинической эффективности различных методик необходима дальнейшая разработка патогенетически обоснованных подходов в ее лечении.
Ключевые слова
Полный текст
Эпидемиология и патогенез
Остеохондрит коленного сустава является распространенной причиной болей и функциональных расстройств нижних конечностей у детей и молодых взрослых. Это патологическое состояние, при котором субхондральная кость становится в начале гипо-, а затем и аваскулярной, что приводит к дестабилизации хондрального покрытия. При прогрессировании заболевания хрящевой, а чаще костно-хрящевой комплекс на ограниченном участке может полностью отделиться от своего ложа при воздействии ударных и сдвигающих сил [8]. Это неизбежно приводит к анатомическому нарушению целостности гиалинового хряща сустава, образованию свободных внутрисуставных тел, существенной потере скользящего эффекта, появлению блоков [3].
Амбруаз Паре описал «внутрисуставные тела» в 1558 г. Кениг был первым автором, который применил термин «рассекающий остеохондрит» в 1887 г. и указал на роль травмы в качестве предрасполагающего фактора. Он же описывал этот процесс как воспалительный, однако в 1926 г. пересмотрел свое утверждение. В то же время Пэджет считал образование внутрисуставных свободных тел следствием аваскулярного некроза [3].
По современным представлениям многих специалистов рассекающий остеохондрит представляет собой патологический процесс, поражающий субхондральную кость коленного сустава. У детей и подростков с открытыми ростовыми пластинами — это ювенильный остеохондрит, а у молодых людей с закрытыми ростовыми пластинами — традиционно рассекающий остеохондрит взрослых. Развитие заболевания в возрасте до 14 лет рассматривается как ювенильная форма болезни Кенига [8]. При отсутствии своевременной диагностики и должного лечения высока вероятность развития тяжелых дегенеративно-дистрофических изменений суставов в молодом возрасте [7].
К причинам, способствующим возникновению заболевания, относят: локальный ишемический некроз субхондральной кости, как и следствие повторных микротравм, нарушение процесса энхондральной оссификации, наследственную предрасположенность и эндокринные расстройства [5].
Начиная с воспалительной теории Кенига, были выдвинуты многочисленные гипотезы относительно истинной патофизиологии, лежащей в основе образования и прогрессирования поражений коленного сустава, но ни одна теория не получила единого мнения. В гистологической картине часто описан некроз субхондральной кости, причем остается неясным, является ли наличие некроза первичным или вторичным в цепи патогенетических изменений [3–6, 20].
Существует теория хронической макротравматизации, ее сторонники утверждают, что первоначальная стрессовая реакция происходит в субхондральной области одного из мыщелков бедра, а при дальнейшей нагрузке приводит к образованию «стрессового» субхондрального перелома. Повторяющаяся нагрузка препятствует заживлению импрессионного перелома и приводит к локальному асептическому остеонекрозу [2]. Свободный остеохондральный фрагмент в дальнейшем расслаивается, отделяясь от ложа перелома, что приводит к нестабильному глубокому повреждению гиалинового хряща [28].
По совокупным данным многих авторов, в 69 % случаев очаг поражения локализуется в латеральной зоне медиального мыщелка бедренной кости, в 6 % — в расширенной, так называемой «классической», зоне с захватом участка нижней нагружаемой поверхности бедра, 10 % приходится на его нижне-центральную нагружаемую зону, а 13 % — на нижне-центральную нагружаемую зону латерального мыщелка бедренной кости. В 2 % случаев некротические очаги находятся в переднем отделе латерального мыщелка бедра [18].
С учетом мнений различных авторов наиболее вероятной можно считать полиэтиологическую теорию развития рассекающего остеохондрита у детей, она включает хроническую микротравматизацию, эндокринный дисбаланс, нарушение процессов оссификации в дистальном эпифизе бедренной кости, нарушение микроциркуляции с ангиоспазмом, инфекционный тромбоз и другие причины [1].
Классификация
Рассекающий остеохондрит коленного сустава условно разделяют на две формы: ювенильную и взрослую. Ювенильный остеохондрит характеризуется дебютом в возрасте 10–15 лет на фоне незакрытых зон роста. Прогностически такая форма считается наиболее благоприятной. Взрослая форма может развиваться в более старшем возрасте, как правило, обычно до 50 лет [9].
Для оценки степени поражения мыщелка бедренной кости J.W. Milgram в 1978 г. представил классификацию заболевания. В соответствии с этой классификацией на основании обзорных рентгенограмм автор выделил 4 стадии заболевания:
Сегодня широко применяется классификация, предложенная Международным обществом восстановления хряща. В этой классификации рассекающий остеохондрит также разделяется на 4 группы по морфологическому признаку:
Для разделения рассекающего остеохондрита по группам указанной выше классификации используются критерии, полученные в результате лучевой, магнитно-резонансной, ультразвуковой диагностики, а также интраоперационной картины сустава.
Клиника
В начальных стадиях заболевание протекает латентно и часто обнаруживается как случайная рентгенологическая находка во время обследования в связи с иной патологией. Основные клинические признаки неспецифичны: боль, дискомфорт в суставе и отек после физических нагрузок [1].
Характерными являются жалобы на боли при осевой нагрузке на конечность в положении легкого сгибания в коленном суставе, усиливающиеся при совершении ротационных движений голени с фиксированной стопой. Возможны и другие общие клинические проявления: хромота, сглаженность контуров сустава, блокады. Активные и пассивные движения в суставе при отсутствии свободных внутрисуставных тел не ограничены. Возможно появление болевого синдрома в положении крайнего сгибания, что обусловлено давлением в проекции суставной поверхности пораженного мыщелка [2].
Рассекающий остеохондрит у взрослых и детей значительно различается по течению и прогнозу. Учитывая это обстоятельство, можно предположить, что речь идет о двух разных заболеваниях [7]. На первой стадии возникает субхондральный некроз губчатой кости и костного мозга, однако суставной гиалиновый хрящ еще сохраняет жизнеспособность. В исходе этой стадии появляется слабое ограниченное уплотнение костного вещества в зоне некроза [38]. Вторая стадия наступает спустя несколько месяцев (обычно 3–4 мес.) от начала заболевания. Происходит деформация костных балок на границе со здоровой костью, трабекулярная структура кости нарушается, структура эпифиза уплотняется и уменьшается по высоте. Суставная поверхность деформируется. Длительность данной стадии составляет 3–5 мес. Третья стадия характеризуется медленной резорбцией некротизированной кости на фоне начавшейся реваскуляризации. Пролиферация фиброзно-хрящевой ткани в виде выступов приводит к фрагментации некротизированного участка кости. Продолжительность этой стадии составляет 1–3 года. Для четвертой стадии характерно замещение костных фрагментов, а также соединительнотканных и хрящевых тяжей новообразованным губчатым костным веществом с грубой структурой (иногда с развитием кист). Длительность стадии варьирует от 6 мес. до 2 лет [40].
Клиническая картина рассекающего остеохондрита характеризуется отсутствием достоверных патогномоничных проявлений, что в определенной степени затрудняет своевременную постановку правильного диагноза [2]. Наиболее часто болезнь Кенига встречается у детей, занимающихся активными видами спорта, но может встречается и у пациентов, ведущих спокойный образ жизни.
Поздняя диагностика заболевания, когда имеется развитие артралгических осложнений (синовиты, болевые синдромы, контрактуры), приводит к пролонгированию патологического процесса до юношеского и более старшего возраста. Это в свою очередь обусловливает развитие гонартроза с последующим выраженным снижением функции сустава и ограничением трудоспособности пациента [2].
Увеличение числа детей с болезнью Кенига в запущенных стадиях требует от врачей большего внимания к длительно текущим болевым синдромам, рецидивирующим синовиитам, блокам и болевым контрактурам коленного сустава. Необходимо проводить тщательную дифференциальную диагностику болезни Кенига с патологией менисков, ревматоидным артритом и целым рядом других специфических патологических процессов [3].
Лечение
Тактика лечения рассекающего остеохондрита коленного сустава зависит от стадии заболевания и выраженности клинической картины. Выделяют хирургическое и консервативное лечение. В недалеком прошлом основным методом лечения являлась артротомия с удалением свободных внутрисуставных тел. Чаще всего артротомию выполняли на заключительных стадиях заболевания, когда имелся костный дефект в области мыщелка бедренной кости. Лечение напрямую зависит как от возраста пациента, так и от стадии патологического процесса [38].
Чаще всего при лечении ювенильного рассекающего остеохондрита у молодых пациентов с незакрывшимися зонами роста и открытыми эпифизами предпочитают консервативное лечение [5, 6]. Консервативное лечение эффективно на ранней стадии заболевания, когда отсутствуют выраженные рентгенологические изменения кости, а на магнитно-резонансной томографии определяется лишь отек костного вещества. На стадии сниженного магнитно-резонансного сигнала от пораженного участка кости также возможно проведение консервативного лечения, но риск развития необратимых изменений микроциркуляции выше, а следовательно, увеличивается вероятность неблагоприятных исходов [13, 14].
Большинство детей, страдающих ювенильным остеохондритом, могут успешно лечиться консервативно [6, 19]. Ребенку не рекомендуются активные физические нагрузки. Выполняют иммобилизацию конечности посредством разгрузочного ортезирования сроком на 6–12 нед. Назначается курс физиотерапевтического лечения. Если у пациента регрессирует болевой синдром, отмечается положительная рентгенологическая динамика, то через 12 нед. разрешается приступать к щадящим нагрузкам на больную конечность, исключая активные занятия спортом и форсированные физические нагрузки. [7].
В настоящее время популярными средствами являются хондропротекторы и протезы синовиальной жидкости [14].
Консервативное лечение при 1–2-й стадии болезни Кенига направлено на оптимизацию процессов регенерации, для чего до недавнего времени использовали электромагнитную стимуляцию в сочетании с разгрузкой сустава [11]. Длительность консервативной терапии при этом составляет от 10 до 18 мес. В течение этого периода полностью исключаются занятия спортом и рекомендуют строгий охранительный режим. Сроком до 2 мес. назначается разгрузка сустава, больному необходимо ходить на костылях, не наступая на больную ногу. При уменьшении болевого синдрома в комплекс консервативной терапии включают курс лечебной физкультуры, включающий несиловые изометрические упражнения [21].
Целесообразно проведение повторных курсов лечения. В недавно опубликованном ретроспективном исследовании 42 больных ювенильным рассекающим остеохондритом коленного сустава у 66 % пациентов со стабильными повреждениями удалось добиться восстановления после консервативного лечения и стойкой ремиссии [13, 14].
На характер течения заболевания и результативность консервативного лечения оказывают влияние такие факторы, как размер патологического очага, возраст и пол. Локализация процесса на мыщелке остается дискутабельным [5, 6].
В современной специальной литературе, посвященной консервативному лечению, сформулированы основные принципы достижения положительного результата: ортопедический режим со снижением спортивных нагрузок и созданием покоя пораженному сегменту, комплексное медикаментозное лечение, направленное на активизацию восстановления, в том числе локальная инъекционная терапия, ресурсы регенеративной медицины, физиотерапевтические процедуры для снижения болевого синдрома, улучшение трофики и активация репарации [12, 14].
Хирургическое лечение показано в случаях, когда неэффективны консервативные мероприятия, а также при нестабильных поражениях, в особенности у взрослых [14]. Ряд авторов рекомендуют хирургическое лечение у детей при рассекающем остеохондрите только лишь при прогрессировании заболевания, ограничиваясь удалением свободных тел [36, 37, 40]. Результаты хирургического лечения болезни Кенига, по данным большинства авторов, лучше у молодых пациентов в возрастной группе от 6 до 12 лет, что обусловлено большим репаративным потенциалом. Неудовлетворительные анатомо-функциональные исходы коррелируют при этом с нетипичными местами поражения хряща и наличием сопутствующих заболеваний [37].
Варианты хирургического вмешательства включают в себя простое удаление фрагмента или свободного внутрисуставного тела, репаративную остеоперфорацию субхондральной кости, рефиксацию фрагмента, микрофрактурирование с пластикой остеохондральными аутотрансплантатами и различные клеточные технологии [11, 16, 17].
С каждым годом возрастают технические возможности малоинвазивной артроскопической хирургии [10–12].
Целью хирургического лечения является максимально качественное восстановление суставной поверхности коленного сустава в минимальные сроки, целесообразно прибегнуть к остеоиндуктивным методам, в случаях витализированных поражений, при явлениях остеонекроза или же реконструктивным с удалением фрагментов или свободных тел [24–26].
В случаях выявления признаков нестабильности коленного сустава, показано хирургическое лечение независимо от возраста пациента. Участки суставного хряща принято считать витализированными, при сохранности субхондрального слоя и полной конгруэнтности суставных поверхностей [25]. К нежизнеспособным повреждениям хряща относят те, которые не могут быть сохранены и стабилизированы, так как они присутствуют в виде свободных внутрисуставных тел или фрагментированы, нарушают конгруэнтность суставных поверхностей, а также определяется патология субхондральной кости [17].
В последнее время наиболее распространенным хирургическим способом лечения пациентов с данной патологией является артроскопический, при котором определяется размер дефекта гиалинового хряща и при необходимости выполняется рефиксация отделившегося фрагмента. Фиксация рекомендуется в случаях свежих травм (до 3 нед.) и наличии крупного, пригодного для этих целей, остеохондрального фрагмента. В остальных ситуациях целесообразно удаление фрагмента, абразивная хондропластика кюреткой с формированием стабильных краев хрящевого дефекта, по возможности, микрофрактурирование зоны дефекта, рассчитанной на индукцию образования фиброзного хряща [1].
Часто используемой методикой сегодня является артроскопическая рефиксация отделившегося костно-хрящевого блока. J. Bruns и соавт. указывают на ряд технических сложностей и рекомендовали осуществлять фиксацию только больших отделившихся фрагментов [29].
W. Robertson и соавт. установили, что дефект в области мыщелка заполнялся тканью, названной ими фиброхрящом. Повторная травматизация этой зоны или незначительная нагрузка приводили к дегенерации хрящевой поверхности [27].
D. Crawforrd и M.R. Safran применяли в качестве фиксирующего материала спицу Киршнера [40]. J.A. Hughes и соавт. [35] при этом считают, что открытая артротомия и внутренняя фиксация свободных костно-хрящевых блоков значительных размеров с помощью спиц Киршнера намного эффективнее, чем удаление фрагментов и кюретаж дна ниши. Тем не менее ряд авторов все же не рекомендовали использовать эту методику из-за частой миграции спиц и свободного фрагмента, отмечая весьма низкий процент приживаемости [27, 38].
F.A. Krappel и соавт. [36] опубликовали данные о методике пластики дефектов у пациентов с рассекающим остеохондритом с помощью аллогенных и аутогенных остеохондральных трансплантатов. Метод заключается в закрытии трансплантатами ниши из других участков суставных поверхностей.
A. Nakamae и соавт. [38] предложили выполнять фиксацию трансплантатов или отделившегося фрагмента с помощью винтов АО/ASIF. Остеосинтез винтами обеспечивает межфрагментарную компрессию и механическую прочность, что создает благоприятные условия для течения биологических процессов регенерации. Удаление металлоконструкции рекомендуют не ранее 8 нед. [36].
Биодеградируемые имплантаты перспективны, поскольку отсутствует необходимость в повторной операции по удалению конструкции. Некоторые авторы высказывают сомнения в необходимости межфрагментарной компрессии при помощи таких винтов, учитывая их скорую ферментативную деградацию [30], реактивный синовиит, сопровождающий имплантированные конструкции, что усложняет процесс восстановления пациентов [32]. Результаты реконструктивных операций с использованием биодеградируемых имплантатов, канюлированных винтов и винтов с частичной резьбой не показывают статистических различий [29].
По мнению ряда авторов, фрагментированные участки хряща вне зависимости от размеров подлежат одномоментному удалению, так как считаются нестабильными, поскольку состоят из грубоволокнистой соединительной ткани, лишены васкуляризации и способны вызывать нестабильность коленного сустава [31–34].
К одному из малоинвазивных способов хирургического лечения рассекающего остеохондрита относится ревасуляризирующая остеоперфорация. Этот метод, вызывающий остеоиндукцию, показал удовлетворительный результаты в 72 % наблюдений, особенно при поражениях менее 2 см 2 [39]. Реваскуляризующая остеоперфорация чаще всего выполняется под артроскопическим контролем, реже путем миниартротомии. Открытая фиксация выполняется в случаях нестабильных поражений с достаточным по размерам субхондральным компонентом [2, 36]. Для выполнения методики используется спица Киршнера или тонкое шило. Перфорационные каналы направлены перпендикулярно к суставной поверхности и проникают вглубь до 2–4 см в толще мыщелка, 5–6 мм неповрежденной кости считается оптимальным расстоянием между перфорированными отверстиями [5, 9]. Однако результаты данной методики показали, что на поздних стадиях при наличии флотации костно-хрящевого фрагмента, ее эффективность не превышает 50 %, а в случаях секвестирования эффективность реваскуляризирущей остеоперфорации остается крайне сомнительной [7, 12, 13].
Обнадеживающие и перспективные экспериментальные и клинические результаты показала комбинированная методика лечения, включающая в себя микрофрактурирование — заполнение дефекта измельченным аутохрящом и покрытием его коллагеновой мембраной, взвешенной в аутоплазме, богатой тромбоцитами [2]. Мозаичная аутоостео-хондропластика применяется при крупных очагах поражения с нарушением целостности субхондральной кости, для которых выполнение микрофрактурирования недостаточно [10, 11].
В литературе имеется большое количество статей по применению этой методики [23, 24, 27]. Она включает в себя забор остеохондральных трансплантатов в виде цилиндров из ненагружаемых зон и их имплантация в область очага поражения с помощью специальных инструментов. Количество пересаженных остеохондральных участков зависит от площади зоны поражения. Хорошие результаты применения этого метода получены в 79–94 % и с рентгенографически подтвержденной интеграцией трансплантата с периодом наблюдения 18 мес. [24, 26]. Однако по мнению других авторов, важным недостатком метода является некупируемый болевой синдром в области донорского ложа [16, 17].
Аутотрансплантация хондроцитов показана для единичных остеохондральных поражений размером более 10 см 2 [9, 11]. Методика проводится в два этапа. В начале артрокопически выполняется санация очага хондромаляции и забор биоматериала. Хондриты культивируют in vitro в течение 3–4 нед., в особых условиях. Затем путем повторной артроскопии полученную массу культивированных хондроцитов имплантируют в очаг после подготовки ложа. Операция завершается герметизацией дефекта, заполненного новыми хондроцитами, с помощью мембраны, которая в том числе является дополнительным средством фиксации [24].
В результате микрофрактурирования, аутохондропластики и аутоимплантации хондритов реституция хрящевого покрова была различная. Многие авторы признали, что микрофрактурирование приводит к образованию гиалинового хряща (коллаген типа II), который произрастает в пространствах между остеохондральными цилиндрами мозаичной пластики [33]. Известен метод комбинированной пересадки ауто- и аллогенных костно-хрящевых трансплантатов [1, 7, 15].
В 1990 г. появилось сообщение о попытке пересадки реберного аутохряща. Дефекты хряща 3–4-й степени закрывали перихондральным трансплантатом, который фиксировали с помощью фибринового клея [7, 32]. Через 1 год при артроскопическом исследовании обнаружено, что дефект хряща был заполнен на 90 %, но через 8 лет было выявлено, что в 20 % случаев наблюдали энхондральную оссификацию пересаженного хряща [16].
P.S. Skagen и соавт. [31] проанализировали результаты биопсии пациентов, перенесших аутотрансплантацию хондроцитов, где наблюдали появление фиброзного хряща без признаков интеграции с окружающими тканями, и посчитали, что термин «гиалиноподобный» некорректен.
M.S. Kocher и соавт. [23] при дефектах гиалинового хряща коленного сустава различного генеза применяли перихондральную трансплантацию.
Еще раньше дефекты заполняли надкостницей, которую укладывали своим камбиальным слоем на поверхность костного дефекта после его дебридмента. При повторном исследовании у большинства таких больных при артроскопии не отмечали признаков хондрорегенерации в месте пластики [6, 32].
Результаты лечения были в целом удовлетворительными, принимая во внимание среднесрочную продолжительность наблюдений [27, 29, 30].
Во всем мире активно развиваются технологии клеточных культур. В 1994 г. ученые из Швеции опубликовали результаты применения аутотрансплантации культивированных хондроцитов (autological chondrocyte implantation — ACI) при лечении дефектов гиалинового хряща коленного сустава [32]. Методика включает две этапные операции: 1) забор 200–300 мг хряща из ненагружаемой поверхности сустава, культивирование хондроцитов в течение 4–6 нед.; 2) введение хондроцитов под закрытый надкостничным лоскутом дефект [12, 33]. К недостаткам относят высокий риск развития периостальной гипертрофии и артрофиброза сустава, требующие ревизионных и мобилизирующих сустав вмешательств [33].
В последующем для закрытия пересаженных хондроцитов стали использовать разнообразные, инертные коллагеновые мембраны [3, 34]. В 2012 г. предложено третье поколение методик ACI, базирующихся на использовании биологических матриц [12].
Другой разновидностью развития клеточных технологий является индуцированный матрицей аутогенный хондрогенез, который выполняется с использованием матрицы, состоящей из свиного коллагена I и III типов. Фиксация матрицы может осуществляться как швами, так и фибриновым клеем. К преимуществам данной методики относится одноэтапность операции без предварительного забора хряща и экономическая целесообразность, ввиду отсутствия необходимости в культивировании хондроцитов [39].
По некоторым данным, мезенхимальные стволовые клетки являются хорошей альтернативой ACI и AMIC, показывая хорошие отдаленные результаты [39, 41].
Изучив мнение многих авторов, считаем, что ключ к успешному замещению дефекта хряща — выработка коллагена с помощью культуры собственных хондроцитов. При заборе ткани из донорского участка хондроциты вырабатывают коллаген II типа. Во время их культурирования изменяются их свойства. Если хондроциты образуют монослойную культуру, то они начинают вырабатывать коллаген I типа. После помещения этой культуры в дефект на суставной поверхности вновь вырабатывается коллаген II типа [19]. После имплантации хондроциты располагаются на границе со здоровым слоем хряща и в дальнейшем полностью интегрируются с ним.
По нашему мнению, задачами хирургического лечения являются восстановление конгруэнтности суставных поверхностей путем улучшения васкуляризации зоны поражения, жесткой фиксации нестабильного фрагмента и защита опорной части нагружаемого отдела мыщелка в послеоперационном периоде. Ввиду редкости такой патологии и отсутствия исследований с высоким уровнем доказательств, необходима дальнейшая разработка методов лечения.