что такое биуретовая реакция белков
Что такое биуретовая реакция белков
Биуретовая реакция
Биуретовая реакция служит для обнаружения пептидных связей. Пептидная связь наиболее характерна для белков, и в этом смысле биуретовая реакция являемся наиболее специфичной. В белках возможны и другие связи, например, сульфидная, эфирная, солевая, водородная. Для обнаружения этих связей биуретовая реакция негодна.
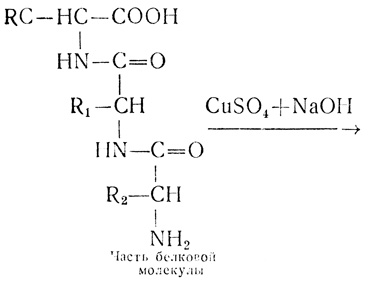
Биуретовая реакция основана на том, что в щелочной среде (в присутствии гидроокиси натрия) при добавлении солей меди (медного купороса) полипептиды и белки образуют окрашенные комплексные соединения с ионом меди.
Хотя отдельные аминокислоты этой реакции не дают, но, как исключение, она возникает в присутствии аспарагина и гистидина.
Отрицательной чертой биуретовой реакции является то, что она малочувствительна. Окрашивание особенно хорошо проявляется только там, где белков много (например, в меристематических клетках).
Проведение биуретовой реакции на свежем материале может дать ослабленное окрашивание из-за слабой проницаемости тканей. Фиксированный материал дает в этом отношении лучшие результаты; однако надо иметь в виду, что фиксация спиртом неприемлема для спирторастворимых белков (как, например, белки зерновых злаков).
1) 7%-ный раствор медного купороса.
2) 30-50%-ный раствор гидроокиси натрия (или калия).
1. Погрузить срез в раствор медного купороса на 5-30 мин в часовом стекле.
2. Тщательно отсосать этот раствор фильтровальной бумагой и промыть срез водой до удаления голубой окраски из промывной воды.
3. Перенести срез на предметное стекло и обработать раствором гидроокиси натрия (или калия) от 10-20 мин до 1 ч.
4. Наблюдать появление фиолетовой окраски (иногда розовой в присутствии низкомолекулярных белков или полипептидов).
Результаты реакции (табл. 17)
Реакция не идет в паренхиме листа капусты и проявляется неярко в тканях пучка.
Эндосперм зерновки кукурузы не дает реакции, не считая алейронового слоя, где она проявляется, хотя и очень незначительно. Зародыш окрашивается ярко.
ЦВЕТНЫЕ И ИМЕННЫЕ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА БЕЛКИ
История химии в школьном курсе
РЕАКЦИЯ ПИОТРОВСКОГО (БИУРЕТОВАЯ РЕАКЦИЯ)
В белках аминокислоты связаны друг с другом по типу полипептидов и дикетопиперазинов. Образование полипептидов из аминокислот происходит путем отщепления молекулы воды от аминогруппы одной молекулы аминокислоты и карбоксильной группы другой молекулы:
Образующаяся группа –С(О)–NН– называется пептидной группой, связь С–N, соединяющая остатки млекул аминокислот, – пептидной связью.
При взаимодействии дипептида с новой молекулой аминокислоты получается трипептид и т. д.
Дикетопиперазины образуются при взаимодействии двух молекул аминокислот с отщеплением двух молекул воды:
Дикетопиперазины были выделены из белков Н.Д.Зелинским и В.С.Садиковым в 1923 г.
Наличие в белке повторяющихся пептидных групп подтверждается тем, что белки дают фиолетовое окрашивание при действии небольшого количества раствора медного купороса в присутствии щелочи (биуретовая реакция).
Реакция идет по схеме:
Это реакция на цистеин и цистин. При щелочном гидролизе «слабосвязанная сера» в цистеине и цистине достаточно легко отщепляется, в результате чего образуется сероводород, который, реагируя со щелочью, дает сульфиды натрия или калия. При добавлении ацетата свинца(II) образуется осадок сульфида свинца(II) серо-черного цвета.
Описание опыта. В пробирку наливают 1 мл раствора цистина, прибавляют 0,5 мл 20%-го раствора гидроксида натрия. Смесь нагревают до кипения, а затем добавляют 0,5 мл раствора ацетата свинца(II). Наблюдается выпадение серо-черного осадка сульфида свинца(II):
Описание опыта. В пробирку наливают 5 капель 1%-го раствора глицина и прибавляют 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавляют равный объем 40%-го раствора формальдегида (формалин). Появляется красное окрашивание (кислая среда):
Это реакция на аминокислоту глицин.
В таких солях ион меди координационными связями соединен с аминогруппами.
Описание опыта. В пробирку наливают 3 мл 3%-го раствора сульфата меди(II), добавляют несколько капель 10%-го раствора гидроксида натрия до образования голубого осадка. К полученному осадку гидроксида меди(II) приливают 0,5 мл концентрированного раствора глицина. При этом образуется темно-синий раствор глицината меди:
Описание опыта. В пробирку наливают 1 мл раствора тирозина и добавляют 0,5 мл концентрированной азотной кислоты. Смесь нагревают до появления желтой окраски. После охлаждения добавляют 1–2 мл 20%-го раствора гидроксида натрия до появления оранжевой окраски раствора:
Описание опыта. В пробирку наливают около
0,5 мл раствора уксуснокислого свинца и прибавляют раствор едкого кали до растворения образовавшегося осадка гидроксида свинца. В другую пробирку наливают
Триптофан, реагируя в кислой среде с альдегидами, образует окрашенные продукты конденсации. Например, с глиоксиловой кислотой (являющейся примесью к концентрированной уксусной кислоте) реакция протекает по уравнению:
По аналогичной схеме протекает и реакция триптофана с формальдегидом.
В ходе проведенного исследования мы выявили по литературным источникам имеющуюся информацию о цветных качественных реакциях на белковые аминокислоты; выполнили ряд перечисленных реакций и составили базу данных. Эта база может быть использована в школьной практике как в теоретическом плане, так и в практическом, т. к. мы приводим краткие, но подробные описания выполнения всех опытов.
Из предложенных 18 качественных реакций каждая практически осуществима в школьном курсе химии и имеет важное практическое значение. Сопровождение реакций химическими уравнениями конкретизирует и углубляет знания по биологической и органической химии, особенно знания учащихся специализированных биологических и химических классов.
Использованная литература
Ермаков А.Н., Арасимович В.В., Смирнова-Иконникова М.И., Мирри И.К. Методы биохимического исследования растений. М.,1952, 520 с.
Полянская А.С., Шевелева А.О. Методическая разработка по лабораторным работам: «Аминокислоты» и «Белки». Л., 1976, 37 с.
Пустовалова Л.М. Практикум по биохимии. 1999, 541 с.
Руководство к практическим занятиям по органической химии. Под ред. В.М.Родионова. М., 1954, 111 с.
Соловьев Н.А. Лабораторные работы по биологической химии. Методическая разработка. СПб., 1996, 70 с.
Филиппович Ю.Б., Егорова Т.А., Севастьянова Г.А. Практикум по общей биохимии. М., 1982, 311 с.
З.Саитов, С.В.Телешов, Б.Харитонцев,
секция «Юный химик» РХО им. Д.И.Менделеева (г. Тобольск)
Клинико-диагностическое значение качественных реакций на белки и аминокислоты
Клинико-диагностическое значение качественных реакций на белки и аминокислоты
Качественные реакции на белки и отдельные аминокислоты нашли широкое применение в практике КДЛ, судебной медицине, научно-исследовательской работе Они применяются для выявления белков и отдельных аминокислот в биологических жидкостях.
Одним из наиболее часто назначаемых врачами-клиницистами анализов, является общий белок в сыворотке крови. Унифицированный метод определения белка называется биуретовым. В его основе лежит биуретовая реакция, изученная нами сегодня.
Причины изменения количества общего белка крови могут быть самыми различными:
Нарушение качественного и количественного состава пищи (голодание)
Нарушение переваривания и всасывания белков в ЖКТ
Нарушение промежуточного обмена белков и отдельных аминокислот (синдром мальадсорбции)
Усиленная потеря белка с биологическими жидкостями и т. д. Поэтому понятно, определение общего белка крови необходимо и в хирургии, и в терапии, и в педиатрии, и в акушерстве и гинекологии.
Однако кроме КДЛ эти реакции нашли свое применение и в других областях медицины и медицинской и биологической науки.
Методами осаждения широко пользуются в клинической практике при анализебелков сыворотки крови и других биологических жидкостей, а также при выделении различных белков, например ферментов, для предварительного осаждения балластных белков или выделения исследуемого фермента.
Биуретовая реакция
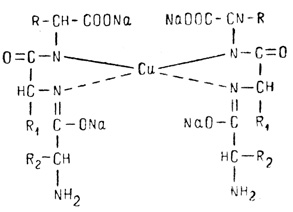
Принцип метода.В щелочной среде в присутствии солей меди растворы белка приобретают фиолетовый цвет с красным или синим оттенком, зависящим от количества пептидных связей в молекуле. Продукты неполного гидролиза белка, содержащие не менее двух пептидных связей, дают биуретовую реакцию с красным оттенком. Реакция обусловлена наличием пептидных групп, которые в щелочной среде образуют с ионами двухвалентной меди окрашенные комплексы.
В щелочной среде пептидная группа присутствует в своей таутомерной енольной форме:
Ион меди взаимодействует с отрицательным зарядом диссоциированной в этих условиях ОН-группой – возникает солеобразная связь; кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их неподеленных электронных пар. Комплексное соединение меди с енолизованными пептидными группами при участии четырех атомов азота можно представить следующим образом:
Ход работы. В одну пробирку наливают 5 капель разбавленного раствора яичного альбумина, во вторую – 5 капель 1%-ного раствора желатина, в третью – 5 капель 1%-ного раствора растительного альбумина. В каждую пробирку добавляют по 10 капель 10%-ного раствора NаОН и по одной капле 1%-ного раствора сульфата меди. Содержимое пробирок тщательно перемешивают. Развивается фиолетовое окрашивание с соответствующим оттенком.
Нингидриновая реакция
Принцип метода.Белки, полипептиды, как и свободные-аминокислоты, дают синее или фиолетовое окрашивание с нингидрином (гидрат трикетогидриндена). Реакция характерна для-аминогрупп аминокислот.
На Iстадии реакции образуется восстановленный нингидрин за счет окислительного дезаминирования (образованиеNН3) и декарбоксилирования (образование СО2)-аминокислот:
На IIстадии образовавшийся аммиак реагирует с эквимолярными количествами окисленного и восстановленного нингидрина, образуя сине-фиолетовый продукт, интенсивность окраски которого (при 570нм) пропорциональна количеству аминокислоты:
Ход работы. В одну пробирку наливают 5 капель разбавленного раствора яичного альбумина, во вторую – 5 капель 1%-ного раствора желатина, в третью – 5 капель 1%-ного раствора растительного альбумина. В каждую пробирку добавляют по 3 капли 0,5%-ного раствора нингидрина и нагревают до кипения. Через 2–3 минуты в пробирках появляется розовое, красное, а затем сине-фиолетовое окрашивание.
Ксантопротеиновая реакция
Принцип метода. При добавлении к раствору белка концентрированной азотной кислоты белок выпадает в осадок, который при нагревании растворяется и жидкость окрашивается в желтый цвет. Эта реакция характерна для ароматических аминокислот (фенилаланина, тирозина и триптофона), которые подвергаются нитрованию:
Нитропроизводное аминокислот в щелочной среде образуют соли хиноидной структуры, окрашенные в оранжевый цвет. Например:
Ход работы. В одну пробирку наливают 5 капель разбавленного раствора яичного альбумина, во вторую – 5 капель 1%-ного раствора желатина, в третью – 5 капель 1%-ного раствора растительного альбумина. Затем в пробирки добавляют по 3 капли концентрированной азотной кислоты и нагревают (осторожно!). При нагревании раствор и выпавший белый осадок или муть от свернувшегося белка окрашиваются в ярко-желтый цвет при наличии ароматических аминокислот: в пробирке с желатином появляется едва заметное бледно-желтое окрашивание (обусловленное незначительной примесью других белков). Пробирки охлаждают, после этого в них осторожно добавляют по 10 капель 30%-ного раствора гидроксида натрия. Выпавший в начале осадок белка растворяется, и жидкость окрашивается в ярко-оранжевый цвет.
Лабораторная работа №2 Биуретовая реакция (Пиотровского)
Провести биуретовую реакцию (Пиотровского)
В 2 пробирки наливают: в одну – 5 капель 1%-ного раствора яичного белка, в другую 5 капель 1% раствора пшеничного белка. В обе пробирки прибавляют по 5 капель 10%-ного раствора едкого натра и по 1 капле 1% раствора сернокислой меди. В обоих пробирках появляется устойчивое красно-фиолетовое (или сине-фиолетовое) окрашивание.
В пробирку наливают 20 капель 10% раствора едкого натра, добавляют 1-2 капли 1% раствора сернокислой меди и перемешивают. Затем набирают в пипетку разбавленный раствор белка и спускают его по стене пробирку так, чтобы он наслаивался сверху. На границе двух слоев жидкости образуется фиолетовое кольцо.
В данной работе мы провели биуретовоую реакцию (Пиотровского). При добавлении к щелочному раствору белка раствора сернокислой меди жидкость приобретает красно-фиолетовое или сине-фиолетовое окрашивание. Реакция обусловлена присутствием в белке пептидных связей, которые с ионами меди образуют окрашенные солеобразные комплексные соединения. Окраска биуретового комплекса зависит от количества медной соли в растворе и от структуры вещества, с которым координирован ион меди. Продукты распада белка – пептоны и полипептиды – дают биуретовую реакцию с красным оттенком.
Лабораторная работа №3 Нингидриновая реакция на α-аминокислоты
Провести нингидриновую реакцию на α-аминокислоты
В 3 пробирки наливают: в одну 5 капель 1% раствора яичного белка, в другую 5 капель дистиллированной воды и добавляют около 0.1 г пшеничной муки, в третью – 5 капель 0.1% раствора глицина.
В каждую пробирку наливают по 2-3 капли 0.1% раствора нингидрина и кипятят.
Через 1-2 минуты появляется розовое, красное, а затем синее окрашивание. При стоянии интенсивность окраски увеличивается.
В данной лабораторной работе провели нингидриновую реакцию на α-аминокислоты. Раствор белка при нагревании с разбавленным раствором нингидрина окрашивается в синий цвет. Реакция обусловлена наличием в белке остатков α-аминокислот. При взаимодействии с нингидрином α-аминокислоты окисляются и распадаются с образованием аммиака, альдегида и угольной кислоты. Нингидрин восстанавливается и конденсируется с другой частицей нингидрина и аммиаком. В результате образуется сложное соединение мурексидного строения, окрашенное в синий цвет.
Лабораторная работа №4 Ксантопротеиновая реакция на циклические аминокислоты
Провести ксантопротеиновые реакции на циклические аминокислоты
В 3 пробирки наливают: в первую 5 капель 1% раствора яичного белка, во вторую – 5 капель 1% раствора пшеничного белка, в третью-5 капель 1% раствора желатина. Во все пробирки добавляют 2-3 капли концентрированной азотной кислоты и нагревают.
В первой и второй пробирках жидкость окрашивается в лимонно-желтый цвет, в третьей получается едва заметное бледно-желтое окрашиваение. Желатин не содержит циклических аминокислот; бледно-желтое окрашивание обусловлено незначительной примесью других белков.
После охлаждения в каждую пробирку добавляют по 10 капель концентрированного раствора аммиака или 30% раствора едкого натра. Окраска жидкости переходит в оранжевую.
В данной лабораторной работе провели ксантопротеиновую реакцию на циклические аминокислоты. При нагревании растворов большинства белков с концентрированной азотной кислотой жидкость окрашивается в лимонно-желтый цвет, переходящий при подщелачивании в оранжевый.
Реакция обусловлена присутствием в белке циклических аминокислот, которые при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные желтого цвета. Последние при добавлении щелочи превращаются в соли хиноидной структуры, окрашенные в оранжевый цвет.