что такое биология при лечении коронавируса
Лечение коронавируса: рекомендации Минздрава
Вспышка пандемии COVID-2019 в прошлом году поставила перед медицинскими работниками непростые задачи, связанные с диагностикой и лечением больных с новой инфекцией. Не исключение и Минздрав, который регулярно создает, редактирует и перевыпускает рекомендации направленные на борьбу с COVID-19.
Почему рекомендации постоянно обновляются?
Когда врачи столкнулись с инфекцией впервые, у них было недостаточно знаний о коронавирусе и мало опыта в лечении пациентов, заразившихся COVID-19. Симптомы болезни сходны с ОРВИ, что затрудняло в первое время диагностику. Также было мало информации о протекании заболевания у детей и беременных женщин.
Как изменился протокол лечения?
В обновленном документе прописаны новые схемы лечения коронавируса, которые позволяют лечить больных в амбулаторных условиях при наличии необходимых условий. Лечиться дома разрешается взрослым пациентам, находящимся в состоянии средней тяжести.
Рентгенография или КТ не являются обязательными процедурами перед выпиской.
Препараты, рекомендованные для лечения
Единой методики лечения COVID сегодня не существует. В первую очередь терапия направлена на предупреждение развития таких грозных осложнений, как пневмония, сепсис, ОРДС.
В зависимости от тяжести состояния и выраженности симптомов, назначают препараты:
Основу терапии составляют противовирусные средства. За время пандемии врачи использовали разные препараты этой группы, но нет оснований говорить о том, что какой-то из этих препаратов действительно эффективен.
16 важных вопросов о коронавирусе врачу красной зоны Александру Ванюкову
Как сейчас лечат COVID-19
Поговорили с Александром Ванюковым — хирургом, заведующим отделением ГКБ № 52 города Москвы, в котором сейчас лечат пациентов с коронавирусной инфекцией.
Что вы узнаете
Будьте внимательны к источникам информации о здоровье — и сходите к врачу
Наши статьи написаны с любовью к доказательной медицине. Мы ссылаемся на авторитетные источники и ходим за комментариями к докторам с хорошей репутацией. Но помните: ответственность за ваше здоровье лежит на вас и на лечащем враче. Мы не выписываем рецептов, мы даем рекомендации. Полагаться на нашу точку зрения или нет — решать вам.
Кто сейчас тяжелее переносит коронавирусную инфекцию?
Как и раньше, тяжелее всего коронавирусную инфекцию переносят пожилые люди, люди с хроническими заболеваниями, в частности с сердечной или почечной недостаточностью, диабетом, а также непривитые люди. Кроме того, довольно плохо переносят болезнь люди с избыточной массой тела.
Факторы риска тяжелого течения COVID-19 — Американский центр по контролю и профилактике заболеваний, CDC
В целом, любые факторы риска со стороны состояния здоровья усугубляют течение коронавирусной инфекции.
Курс о больших делах
Изменилось ли течение болезни с появлением новых штаммов коронавируса?
Теперь болезнь быстрее развивается. Раньше мы видели, что инфекция постепенно прогрессирует в течение двух недель. Сейчас состояние может быстро ухудшиться за три-четыре дня, причем до критического уровня. Также болезнь стала контагиознее, ей проще заразиться.
Ситуация стала хуже с точки зрения переносимости коронавирусной инфекции и ее распространения.
Еще можно отметить, что сейчас вирус стал вызывать не потерю, а скорее девиацию, то есть изменение обоняния. Например, людей преследует какой-то запах, привычные вещи пахнут не так, как раньше.
Растет ли число молодых людей с COVID-19 и как они переносят болезнь?
Сейчас больше стало молодых пациентов, которые болеют тяжело.
При этом в целом молодые люди по-прежнему легче переносят инфекцию. Все-таки у пожилых рисков гораздо больше.
Много ли в стационаре вакцинированных пациентов, как они переносят болезнь?
Среди всех пациентов у нас около 10% тех, кто прошел полный курс вакцинации, из них в реанимации единицы, а погибших можно пересчитать по пальцам.
Тот факт, что вакцинированный человек попал в реанимацию или погиб, не всегда связан с тяжестью коронавирусной инфекции, чаще с его хроническими заболеваниями. Обычно это пожилые, уже тяжело болеющие люди.
Как лечить легкую коронавирусную инфекцию дома?
Если человек находится дома и неплохо себя чувствует, ему ничего не надо принимать, кроме жаропонижающих. Существует много противовирусных препаратов, которые часто назначают, но у них нет доказанной эффективности, принимать их не стоит.
Как лечить легкую коронавирусную инфекцию — Национальная служба здравоохранения Великобритании
При легкой коронавирусной инфекции, как при любой ОРВИ, нужно пить побольше жидкости, соблюдать постельный режим и сбивать температуру.
Как понять, что состояние ухудшается и пора ехать в стационар?
Есть два объективных признака, которые говорят, что нужна госпитализация:
Важно и субъективное самочувствие. Если у человека нарастает интоксикация, он чувствует себя плохо, ничего не может делать, появляется одышка, не хватает воздуха — это тоже повод задуматься о госпитализации.
Необязательно для этого заранее делать компьютерную томографию — ее сделают в больнице. Предварительная КТ только увеличит время до госпитализации, она не изменит тактику. Не надо никуда ехать самому, это не ускорит и не облегчит процесс госпитализации.
КТ нужна врачам потом, чтобы ориентироваться, как болезнь прогрессирует: ждать ухудшения или, наоборот, процесс остановился. Реальное ухудшение самочувствия не всегда совпадает с тем, что видно на томограмме: развитие болезни часто идет впереди изменений на КТ.
Как подготовиться к госпитализации в коронавирусную больницу?
В зависимости от региона в больнице могут понадобиться разные вещи. Общая рекомендация — надо иметь в виду, что человек долгое время проведет в четырех стенах.
Стоит взять с собой телефон, ноутбук, какие-то развлечения, книги. Также нужна удобная одежда, в которой можно находиться долгое время, скажем, спортивный костюм.
При поступлении в стационар стоит сразу сказать, кому можно передавать информацию о состоянии здоровья. Больница на карантине, внутрь родственников не пускают, что-то узнать можно только через справочную. А там не всем говорят, поскольку есть закон о защите медицинской информации. Скажут только тем, кому пациент разрешил передавать свои данные.
Желательно оповестить о госпитализации родственников, чтобы они потом не искали человека по всему городу.
Могут ли родственники пациента, госпитализированного с коронавирусом, чем-то помочь врачам?
Тут все индивидуально, может отличаться в разных ситуациях. В нашу больницу можно прийти волонтером и ухаживать и за своими, и за чужими родственниками. Так можно поддерживать связь с близкими, а также сильно помочь и врачам, и другим пациентам.
«МыВместе» — волонтерский благотворительный проект
Врачи устают, не всегда у них есть время на общение. Волонтеры следят, чтобы людям было максимально комфортно, помогают пациентам сохранить чувство собственного достоинства.
Также они помогают связаться с родственниками, особенно важно это для пожилых людей, плохо владеющих современными технологиями. Волонтер может помочь позвонить, поговорить по видеосвязи, передать записочки.
Больница — это не тюрьма, человеческое общение не только с медицинским персоналом дорогого стоит. Также есть данные, которые показывают, что пациенты, контактирующие не только с санитарками, медсестрами и врачами, лучше переносят болезнь и раньше выписываются.
Как долго человек обычно находится в стационаре?
Продолжительность госпитализации зависит от того, насколько быстро врачи справляются с инфекцией. Когда вирус в крови больше не обнаруживается, поражение легких регрессирует или застывает на месте, не появляются новые очаги, медики принимают решение о выписке.
Некоторые пациенты выписываются за неделю, другие проводят в больнице полгода — это индивидуальная история, которая зависит от того, как человек отвечает на лечение.
Средний минимальный срок нахождения в стационаре с COVID-19 больше, чем с обычным воспалением легких: он составляет две недели.
После выписки из стационара человек еще две недели находится в карантине. Это не всегда обоснованно, но помогает обезопасить окружающих.
Какие бывают последствия госпитализации с коронавирусной инфекцией?
Существует целый список осложнений, которые довольно опасны для жизни. Более того, они никак себя не проявляют, пока не возникнут. Коронавирусной инфекцией все не заканчивается, к сожалению.
Вот несколько самых распространенных осложнений:
Как быстро восстанавливаются после перенесенной коронавирусной инфекции?
Реабилитация после коронавируса — Всемирная организация здравоохранения
Если говорить о государственной системе, после выписки мы рекомендуем таким пациентам получить направление на реабилитацию у участкового терапевта — в поликлинике по месту жительства.
Можно ли снизить риски перехода легкой формы коронавирусной инфекции в тяжелую?
Причем, по моему мнению, лучше вакцинироваться любой зарегистрированной вакциной, чем никакой. Да, «ЭпиВакКорона» вызывает сомнения, и эффективность ее ниже, чем у «Спутника V» и других, тем не менее, похоже, она все равно в какой-то мере работает.
Прививка от COVID-19 — это единственное, что пока может в десятки раз снизить риск попадания в реанимацию.
Можно ли принимать антикоагулянты или глюкокортикоидные гормоны для профилактики осложнений?
Самостоятельное назначение таких грозных лекарств, как антикоагулянты или гормоны, обычно приводит к тому, что врачи потом борются еще и с последствиями приема таких препаратов.
Антитромботическая терапия при COVID-19 — Национальная служба здравоохранения Великобритании
К их назначению есть строгие показания, эти лекарства обычно не назначают пациентам вне стационара. Лекарства, как правило, требуют мониторинга тех или иных показателей крови. Прием антикоагулянтов на догоспитальном этапе не показал своих преимуществ. А прием гормональных препаратов может серьезно навредить.
Существует ли специфическое лечение коронавирусной инфекции?
Работающих противовирусных препаратов нет. Однако сейчас появляются моноклональные антитела, которые блокируют рецепторы вируса и не позволяют ему проникать в клетку.
Моноклональные антитела против COVID-19 — Национальная служба здравоохранения Великобритании
В России они доступны, их применяют в нашей больнице, частично в рамках исследования. Они показали эффективность: если их вовремя назначить, болезнь протекает легче. По некоторым данным, они также могут предотвратить переход инфекции в тяжелую форму, но пока это до конца не подтверждено.
Кроме борьбы с вирусом, лечение коронавирусной инфекции направлено на угнетение иммунного ответа, который вызывает повреждение легких и другие тяжелые осложнения.
Появляются ли новые подходы к лечению коронавируса?
Например, те же противовирусные моноклональные антитела — новая точка приложения для подобных лекарств. Появляются новые препараты с новыми мишенями для них.
Схемы лечения меняются все время. Так, в начале пандемии считалось, что гормональные препараты усугубляют течение болезни, а теперь их активно применяют у тяжелых пациентов.
Кроме того, новые штаммы немного иначе реагируют на лечение, поэтому мы находимся в бесконечном поиске: что работает, что не работает, что безопаснее. Устоявшейся схемы лечения нет и еще долго не будет.
Отличаются ли российские рекомендации по лечению от международных?
Все клинические рекомендации довольно похожи, поскольку сейчас весь мир находится примерно на одной стадии изучения коронавирусной инфекции и борьбы с ней.
Российские рекомендации практически не отличаются от международных, за исключением ряда нюансов. Например, включения в них противовирусных препаратов без доказанной эффективности. Но и наши рекомендации довольно быстро меняются: тут же редактируются, как только появляются новые данные.
Гонка во спасение: безопасны ли вакцины против коронавируса?
Гонка во спасение: безопасны ли вакцины против коронавируса?
По мнению многих специалистов, только создание эффективной вакцины сможет избавить человечество от проблем, связанных с новым коронавирусом
Автор
Редакторы
Несколько месяцев назад один из ведущих экспертов по прививкам, американский врач Пол Офит, назвал прогнозы о начале массовой вакцинации против коронавируса ранее чем полтора-два года «абсурдно оптимистичными». Однако клинические исследования первых вакцин уже начались, в том числе, в России: их вовсю тестируют на добровольцах, а китайскую векторную вакцину Ad5-nCoV одобрили для вакцинации военных! Чем грозит подобная спешка и не скажется ли она на качестве кандидатов на роль панацеи против «чумы XXI века»?
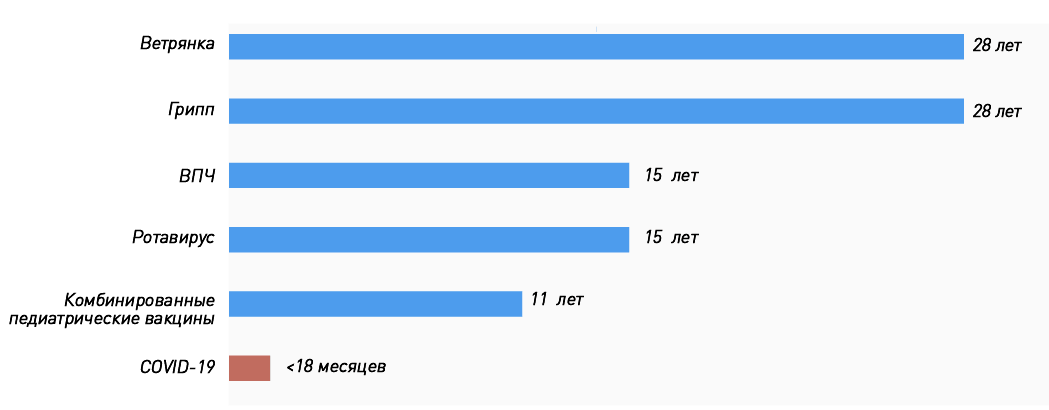
Мы привыкли, что процесс разработки вакцины от идеи до массовых прививок занимает не один год, и каждый препарат проходит несколько стадий исследований (тестирование в лаборатории, на животных, три фазы клинических исследований на людях), участие в которых принимают от 10 000 до 50 000 человек. Кажется естественным, что такие исследования длятся годами (на «Биомолекуле» есть целый спецпроект, посвященный вакцинации). Фактически история вакцинации [1] не знает примеров, когда вакцину от абсолютно нового возбудителя приходилось бы разрабатывать в условиях пандемии и быстрого распространения инфекции. А если прибавить сюда современные технологии, когда геном вируса расшифровали за считанные недели, ситуация становится и вовсе уникальной. Поэтому нет большого смысла «примерять» сроки создания уже существующих вакцин (рис. 1) к коронавирусным.
Рисунок 1. Годы, ушедшие на разработку некоторых вакцин: от идеи до регистрации. Сроки разработки вакцин против ВПЧ и ротавируса включают время, прошедшее от появления прототипа до регистрации препарата.
Рекордные сроки создания ОПВ в первую очередь связаны с тем, что вакцинные штаммы были уже разработаны: американский вирусолог Альберт Сэйбин передал их советским ученым, так как в США не только медлили с внедрением живой вакцины, но и возводили на ее пути всевозможные препятствия. Во-первых, там уже прививали инактивированной полиовакциной (пусть не очень эффективной, но все равно значительно снизившей заболеваемость). Во-вторых, считалось, что живые вакцинные штаммы потенциально опасны, так как в редких случаях будут вызывать параличи (как впоследствии и оказалось). Тем не менее введение ОПВ в СССР в первый же год позволило снизить заболеваемость в десять и более раз (читайте на «Биомолекуле» интервью с сыном одного из разработчиков ОПВ Константином Чумаковым [3]). В одной только Эстонии она уменьшилась с 963 случаев в 1958 году до 8 — в 1959 году [4].
И это не единственный пример: живая рекомбинантная вакцина против лихорадки Эбола от компании MSD (Merck, Sharp and Dohme) Ervebo тоже прошла этот путь довольно быстро: с 2013 года, когда был произведен первый лот для клинических исследований, до регистрации в 2019 году [5], [6]. Причем массово прививать ею начали еще до официальной регистрации.
Эта вакцина просуществовала на рынке всего 9 месяцев. За это время было привито 79 600 доз. О том, что в редчайших случаях она может стать причиной инвагинации, было известно и до регистрации: по данным клинических исследований III фазы среди 10 054 привитых было 5 случаев против одного в контрольной группе (4633 участника). На основании этой информации Консультативный комитет по практике иммунизации (ACIP) рекомендовал постлицензионный мониторинг инвагинации у привитых. Для справки: инвагинация кишечника встречается у младенцев со средней частотой 1,5–4 случая на 1000 детей. Наиболее частая ее причина — вирусные кишечные инфекции.
В истории вакцинации были и другие неудачи:
Эта неудача не остановила исследователей — новая живая вакцина против RSV сейчас проходит клинические исследования на детях [9].
Короче говоря, от проколов не застрахован никто, поэтому сейчас многих волнует вопрос, не скажется ли беспрецедентная гонка в разработке вакцин против SARS-CoV-2 на их безопасности. Масла в огонь подливает ВОЗ, которая стремится упростить разработку и дает зеленый цвет контрольным исследованиям, когда привитых добровольцев заражают коронавирусом, чтобы ускорить процесс тестирования и приблизить начало массовых прививок.
Адекватно ли это сложившейся ситуации (коронавирус все-таки не чума и не лихорадка Эбола) и не обернутся ли «упрощения» боком? Этот вопрос я задала Представительству ВОЗ в РФ. Во Всемирной организации здравоохранения считают, что ничего подобного не произойдет, а разработке поможет беспрецедентное международное сотрудничество:
«Международная инициатива ACT Accelerator дает возможность ученым, врачам, финансовым организациям и производителям со всего мира сотрудничать и делиться данными. Это ускорит разработку вакцины, поскольку позволяет использовать разные совместные стратегии:
В целом, ускоренная разработка не означает экономии в отношении безопасности и/или эффективности: каждая вакцина-кандидат будет оцениваться с использованием строгих критериев, установленных ВОЗ; к каждой будут применяться высокие стандарты и правила, касающиеся любой вакцины, одобренной для использования национальными и международными регулирующими органами».
Страшное слово «вакцина»
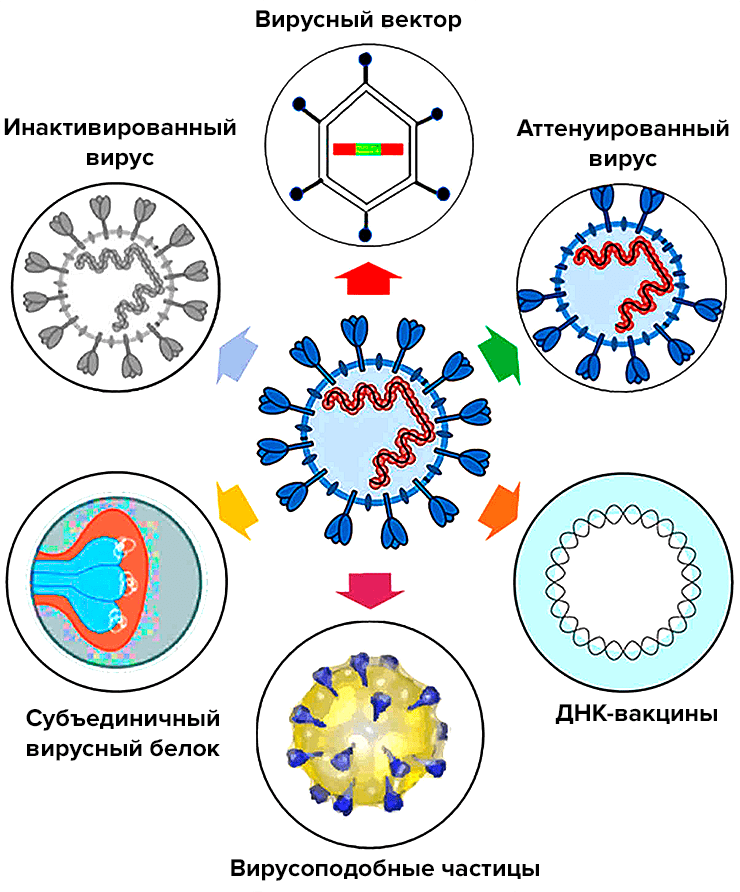
Каждую неделю перечень разрабатываемых вакцин от COVID-19 на сайте ВОЗ пополняется новыми кандидатами (рис. 2) [10]. В разработке используются разные технологии, и Всемирная организация здравоохранения планирует потратить 18,1 млрд долларов на закупку 2 млрд доз разных видов вакцин, «чтобы все имели возможность получить необходимые дозы» (а не только жители стран-разработчиков).
Рисунок 2. Виды разрабатываемых вакцин против SARS-CoV-2. Несмотря на обилие кандидатов и разнообразие подходов, до финиша, скорее всего, дойдут считанные вакцины: многие отсеются на стадии доклинических и клинических исследований. Наряду с обычными инъекционными препаратами разрабатывается несколько интраназальных вакцин (в том числе в питерском Институте экспериментальной медицины). Такие вакцины вводятся в виде назального спрея и в первую очередь защищают слизистые — «входные ворота» инфекции, — так как помимо иммуноглобулинов IgG, стимулируют еще и выработку IgA, которые играют заметную роль в противодействии возбудителям респираторных и кишечных заболеваний.
Практически все прототипы уже находятся на тех или иных фазах исследований, а китайскую векторную вакцину от CanSino Biologics недавно одобрили для вакцинации китайских военных. В стадии исследований на добровольцах находятся более 20 вакцин:
Что это за вакцины?
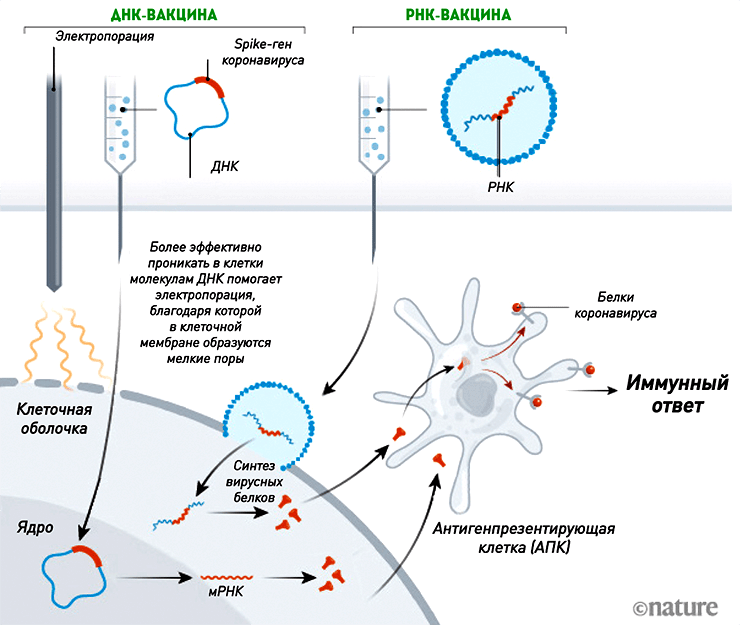
ДНК- и РНК-вакцины
S — от англ. слова spike — «шип».
Рисунок 3. Механизм действия ДНК- и РНК-вакцин. Нуклеиновые кислоты проникают в клетки и запускают синтез копий вирусных белков, к которым впоследствии вырабатывается иммунитет. Несмотря на то, что ДНК проникает в ядро для осуществления транскрипции, ни плазмидная ДНК (за крайне редким исключением [39]), ни мРНК не встраиваются в геном клетки.
Эти безвредные белки экспонируются на поверхности клеток. Что происходит дальше и как именно формируется иммунная память, подробно показано в видео 1.
Видео 1. Развитие иммунного ответа и формирование иммунной памяти
У вакцин на основе нуклеиновых кислот масса достоинств:
У РНК-вакцин есть отдельные преимущества:
Недостатки у этих вакцин тоже имеются:
Потенциальными рисками мРНК-вакцин могут стать аутоиммунные реакции и образование тромбов [13]; бактериальные плазмиды ДНК-вакцин теоретически (но маловероятно) могут нести гены устойчивости к антибиотикам.
Технологии производства нуклеиновых вакцин появились в начале 1990-х годов. И хотя до сих пор нет ни одной одобренной для людей ДНК- или РНК-вакцины, их используют в ветеринарии (ДНК-вакцина против вируса Зика для лошадей), а препараты на основе рекомбинантной плазмидной ДНК разрабатывают для генной терапии некоторых заболеваний (в том числе раковых) [14]. Поэтому нельзя сказать, что такие вакцины — нечто абсолютно новое и неизученное (рис. 3).
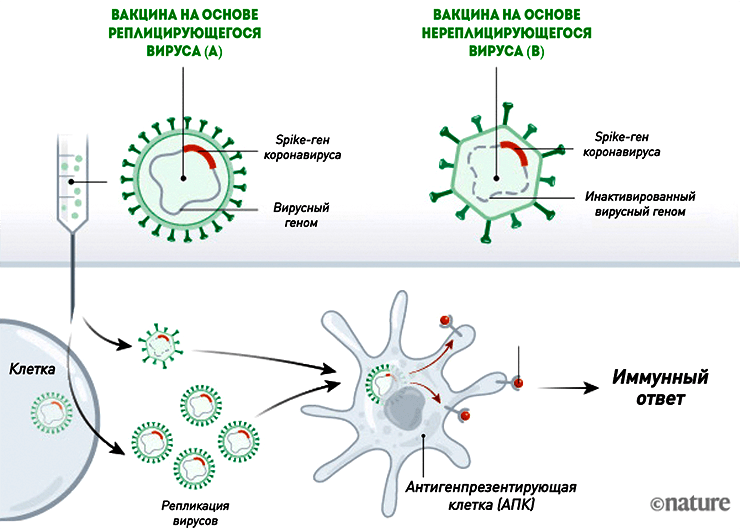
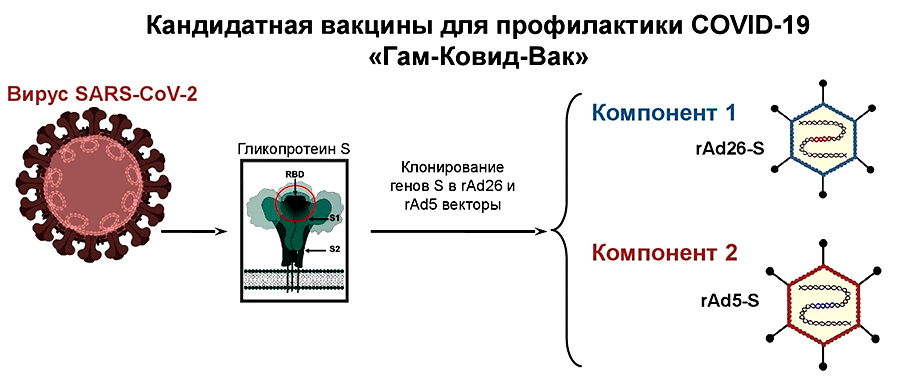
Векторные вакцины
Во многом они похожи на нуклеиновые, но, в отличие от них, уже используются для вакцинации людей против лихорадки Эбола. Такие вакцины от COVID-19 состоят из безопасного для человека вируса (вектора), в геном которого встроен ген SARS-CoV-2, кодирующий S-белок. Вместе с вакциной вектор проникает в восприимчивые к нему клетки и запускает синтез «начинки» (белков) — тех самых шипиков оболочки коронавируса (рис. 4). Сам вектор обычно не воспроизводится, так как нужные для этого гены «отключены». Благодаря этому векторные вакцины являются довольно безопасными [11].
Рисунок 4. Механизм действия векторных вакцин. Такие вакцины бывают двух видов: на основе размножающегося (реплицирующегося) вектора (A) и нереплицирующегося (B).
Клинические исследования с участием онкологических больных показали, что большие дозы аденовирусных векторов нельзя вводить внутривенно. Кроме того, при многократном введении они могут вызвать цепную реакцию активации тромбоцитов, которая чревата токсическим шоком. Но все не так страшно, потому что «существуют практические способы блокировать действие активирующего фактора тромбоцитов и снизить токсичность, обусловленную этим путем». Важно понимать, что к вакцинам эти нежелательные явления не относятся: их не вводят внутривенно, да и лечебные дозы значительно больше профилактических, но, как говорится, «предупрежден — значит вооружен».
Хочу заметить, что вообще-то подобные вещи не должны практиковаться, потому что эффективность любой экспериментальной вакцины в предотвращении заражения до начала клинических исследований неизвестна. Поэтому при работе сотрудники должны соблюдать все необходимые правила безопасности, а не прививаться.
Векторные вакцины на основе реплицирующегося вируса
С ними немного сложнее, так как это конструкция два-в-одном: берут уже существующий живой вакцинный вирус (например, вирус гриппа или кори), в геном которого встраивают нужный ген SARS-CoV-2. В результате получается гибрид: вирион векторного вируса плюс ген белка оболочки коронавируса (рис. 4). Попадая в клетки, вектор начинает размножаться, поэтому теоретически такая вакцина должна убивать сразу двух зайцев: обеспечивать защиту против кори или гриппа и COVID-19. Большое преимущество реплицирующихся векторов в том, что технология культивировани и свойства векторных вирусов известны, так как их годами используют для вакцинации. С другой стороны, вектор должен быть правильно «сконструирован», а иммунный ответ — формироваться к обеим его составляющим: не должно быть такого, что к одному из антигенов вакцины иммунитет будет менее стойким, чем ко второму.
Векторный вирус не обязательно представляет собой гибрид — это может быть, к примеру, вакцинный вирус кори со встроенным геном, который срабатывает на промежуточном цикле, синтезируя нужный белок. В этом случае на выходе из клетки будут два «продукта»: вирусы кори и белки коронавируса.
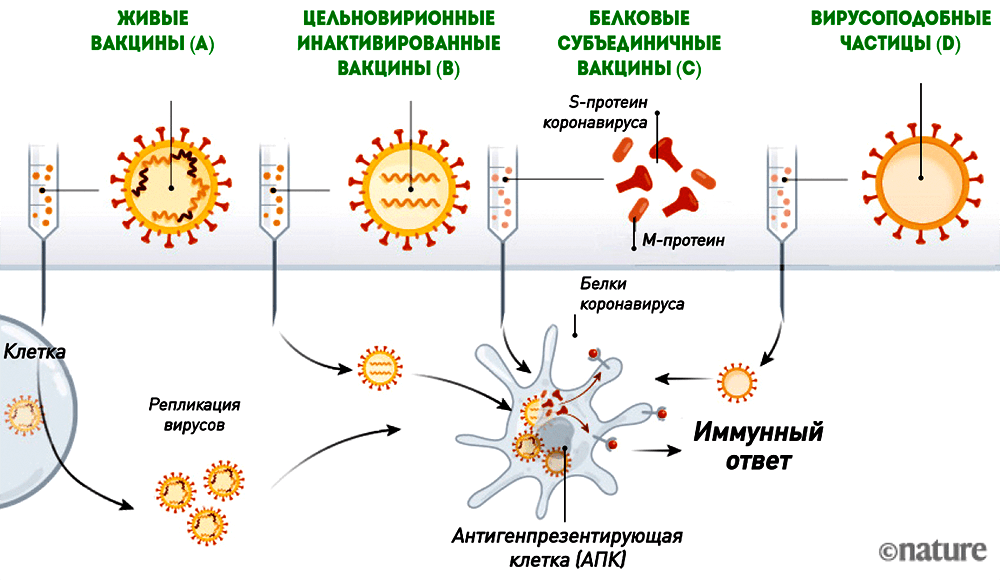
Живые, инактивированные, вирусоподобные и белковые вакцины
Антигеном этих вакцин является либо вирион коронавируса (живой или инактивированный), либо вирусные белки, к которым формируется иммунный ответ (рис. 6).
Рисунок 6. Живые вакцины (A), цельновирионные инактивированные вакцины (B), белковые субъединичные вакцины (C) и вирусоподобные частицы (D)
Живая вакцина — самая трудоемкая и сложная в разработке, но при этом обеспечивающая наиболее эффективный и длительный иммунитет. Ее антигеном является живой аттенуированный (то есть ослабленный) штамм (рис. 6А). Получить его можно, ослабив исходный вирус таким образом, чтобы он стал безопасным для человека, но при этом обеспечивал иммунитет к оригиналу. Этот процесс требует многократного пассирования вируса в клеточных линиях, где ему «позволяют» размножаться и мутировать до тех пор, пока исследователи не получат штамм с нужными свойствами. Живой вакцинный вирус сохраняет способность к размножению, поэтому разработчикам необходимо убедиться, что он действительно безопасен для человека. О разработке живой вакцины против коронавируса заявили всего несколько производителей. Это неудивительно, так как работа над ней требует специализированной платформы и технологии быстрого культивирования вакцинного штамма. Вряд ли живая вакцина появится и будет зарегистрирована так же быстро, как РНК- или векторная.
Инактивированные вакцины тоже содержат исходный вирус, но с «подрезанными крылышками» — размножаться он не может, так как инактивирован («убит») нагреванием или дезинфицирующими средствами (рис. 6B).
Белковые субъединичные вакцины содержат только необходимые для стимуляции иммунитета вирусные белки (рис. 6C), которые сейчас чаще всего получают с помощью рекомбинантной экспрессии.
Вирусоподобные частицы (virus-like particles, VLP) — это вирион-пустышка без генетической «начинки», который сам по себе является антигеном (рис. 6D).
Инактивированные, субъединичные и VLP-вакцины более безопасны, но менее эффективны, чем живые, поэтому ими обычно прививают несколько раз. Наиболее эффективна из них цельновирионная инактивированная, содержащая целый убитый вирус, но чем больше вирусных белков (пусть и инактивированных) поступает в организм, тем выше реактогенность.
Производство и разработка этих вакцин требует соблюдения множества условий:
Есть ли альтернативы?
В начале пандемии было много разговоров о том, что уберечь от SARS-CoV-2 (по крайней мере, в краткосрочной перспективе) могут старые-«добрые» живые вакцины: БЦЖ, противокоревая, ОПВ [16], а в Японии чудодейственную силу приписывали даже вакцинам против клещевого энцефалита [17] (хотя для этого не было никаких серьезных оснований). В общем, складывалось впечатление, что ученые хватались за любую соломинку и старались доказать ее эффективность.
Самые большие надежды возлагались на вакцину против туберкулеза — БЦЖ [18]. О ее влиянии на клеточный иммунитет и уменьшение смертности среди привитых младенцев известно довольно давно [19]. Также не секрет, что ее используют при лечении рака мочевого пузыря. Однако причем тут защита от коронавируса? Выдвигались разные аргументы. Например, разница в количестве смертельных исходов от COVID-19 в странах, где БЦЖ прививают (Япония, Бразилия), и там, где эту вакцину уже давно не используют для массовой вакцинации (США, Италия, Нидерланды) [20]. Действительно, весной 2020 года в Италии и США смертность была высокой, тогда как в Японии и Бразилии — на удивление низкой. Сейчас уже ясно, что младенческая вакцинация БЦЖ здесь ни при чем: в Бразилии (как, впрочем, и в нашей стране) не произошло никакого «коронавирусного» чуда, но тогда об этом еще никто не знал. Кроме того, некоторые надежды внушали данные по заболеваемости в Германии: в восточной части страны (бывшей ГДР, где БЦЖ прививали всем младенцам по примеру СССР) заболеваемость и смертность были значительно ниже, чем в западной (бывшей ФРГ).
Сейчас идут исследования влияния младенческой вакцинации БЦЖ на смертность от COVID-19. Предварительные (и весьма обнадеживающие) данные были получены в нескольких городах Южной Америки. Однако есть нюанс: так как не существует единой общемировой системы учета смертности от коронавируса, непонятно, насколько оптимистична эта информация. Если в статистике учитываются только смерти, причиной которых стал непосредственно SARS-CoV-2, этим выводам грош цена. К тому же, если у БЦЖ действительно есть защитный эффект, он бы уже показал себя в Испании, где этой вакциной массово прививали до 1981 года.
То же самое касается противокоревой прививки. Да что там прививка — массовая вакцинация против кори началась в США только в 1968 году, и те, кто родился раньше, успел ею переболеть. Но получается, что именно люди, натренированные болезнью и имеющие стойкий иммунитет, находятся в группе наибольшего риска осложнений и летального исхода от коронавируса. Несомненно, живые вакцины стимулируют клеточный иммунитет и влияют на общую защищенность привитых от вирусных и некоторых бактериальных заболеваний (неспецифический защитный эффект), но это не длится годами!
По данным in vitro, SARS-CoV-2 наиболее чувствителен к интерферонам альфа и бета и их формам [25].
Константин Чумаков (c которым на «Биомолекуле» недавно вышло интервью [3]), профессор Университета Джорджа Вашингтона и Мэрилендского университета, заместитель директора по науке в отделе вакцин FDA считает, что такое более чем возможно. Свое мнение он основывает на исследованиях ОПВ, проведенных его родителями Михаилом Чумаковым и Мариной Ворошиловой в 1970-х годах во время сезонных эпидемий гриппа: «. мои родители обнаружили, что (. ) когда детей прививали этой вакциной, безопасный вакцинный вирус вытеснял все другие вирусы, которые обычно можно найти у здоровых детей. Самое интересное произошло в 1970 году, когда они провели клинические исследования на более чем 60 000 людей, и при этом выяснилось, что вакцина против полиомиелита защищает от гриппа лучше, чем противогриппозная вакцина. Примечательно, что моя мама была единственным в мире исследователем, который изучал этот эффект систематически» [26].
Здесь необходимо сделать уточнение: на стр. 7 статьи Марины Ворошиловой Potential Use of Nonpathogenic Enteroviruses for Control of Human Disease написано, что она изучала влияние на сезонные вирусные заболевания не только ОПВ, но и живых энтеровирусных вакцин (LEV), штаммы для которых были получены в результате исследования кала здоровых новорожденных младенцев и детей старшего возраста [24].
Звучит многообещающе, но проблема в том, что эти эксперименты были проведены 50 лет назад на взрослых, многие из которых не были привиты против полиовирусов в детстве или не переболели ими (массовое применение ОПВ в СССР началось в 1960 году). Сейчас ситуация абсолютно иная: подавляющее большинство взрослых во всем мире привиты полным курсом из 5–10 доз ОПВ, так что они надежно и, скорее всего, пожизненно защищены от полиовирусов. Это значит, что если привить ОПВ взрослым из групп риска, вакцинные вирусы будут нейтрализованы защитными антителами.
Однако в развитых странах мира ОПВ давно не используют, и многие молодые взрослые привиты инактивированной вакциной. Может быть, стоит привить ОПВ им? Тоже вряд ли — не факт, что и в этом случае ОПВ будет иметь эффект: полный курс ИПВ все-таки эффективен, поэтому вакцинные вирусы будут нейтрализованы уже существующими антителами. Мало того, здесь есть еще одна проблема: привитые живой полиовакциной выделяют мутировавшие в их организме вакцинные вирусы в окружающую среду. И случается, что они вновь обретают свойство вызывать параличи. Хотя опасности будут подвергаться не все, а только непривитые, частично привитые или по каким-либо причинам утратившие иммунитет после вакцинации (в том числе из-за трансплантации костного мозга или онкологических заболеваний [27]), перспектива появления на «чистых» территориях полиовирусов, произошедших от вакцинных, вряд ли приемлема.
И наконец главный вопрос: на каком основании мы сравниваем между собой сезонный грипп и SARS-CoV-2? Это абсолютно разные по своим свойствам вирусы, поэтому как бы заманчиво ни звучали результаты исследований Марины Ворошиловой, имеет ли смысл сильно обнадеживаться? Даже если ОПВ эффективна в краткосрочной перспективе (этот момент собираются исследовать в Институте вирусологии человека при Медицинской школе Мэриленда), что дадут эти несколько недель? Вряд ли неспецифический эффект будет настолько мощным, что полностью остановит передачу инфекции. Судя по всему, без специфической вакцины против SARS-CoV-2 обойтись не удастся.
Вакцины против коронавируса: безопасность и эффективность
Сказать, что в нашей стране настороженно относятся к прививкам — ничего не сказать! Минимум 20% населения и каждый пятый медицинский работник если не являются их противниками, то хотя бы считают, что «прививки — это небезопасно». Поэтому не удивительно, что в последние недели в соцсетях и СМИ поднялась огромная волна страха в отношении разрабатываемых вакцин: их называют «бомбой замедленного действия», советуют относиться с предельной осторожностью, почему-то сравнивают с вакциной против лихорадки денге (хотя это абсолютно другая история). Складывается впечатление, что большинство обсуждающих надеются если и переболеть COVID-19, то бессимптомно. И мало кого волнует, что лечат его отнюдь не безопасными и далеко не всегда эффективными препаратами с большим количеством побочных эффектов, из которых аллергия, наверно, самый безобидный. Помните противомалярийные лекарства (гидроксихлорохин и хлорохин), которые сначала рассматривали как панацею [25]? В середине июня их запретили использовать для лечения коронавируса в США из-за кардиотоксичности и негативного влияния на смертность [28]! А фавипиравир, азитромицин, антикоагулянты, моноклональные антитела, низкомолекулярные гепарины? Все они являются достаточно агрессивными медикаментами с серьезными нежелательными эффектами.
Фактически мы находимся в ситуации, когда «в полевых» условиях (то есть на пациентах) тестируют эффективность разных лекарственных препаратов — иного выхода нет. Пока нет. Только эффективная вакцина поможет вздохнуть спокойнее и более-менее вернуться к привычному ритму жизни. Но проблема в том, что многие боятся прививок больше чем лекарств, хотя для этого нет оснований. Чтобы доказать это, я собрала наиболее частые вопросы, касающиеся разрабатываемых вакцин против SARS-CoV-2, и постаралась ответить на них максимально объективно, а два особо каверзных задала к.ф.н., исполнительному директору ООО «ИФАРМА» Наталье Востоковой. Пожалуй, с них и начну.
Исследования
Анна Ремиш (АР): Многие боятся, что в условиях спешки вакцины против коронавируса не успеют как следует исследовать. Люди считают, что нельзя начинать массовую вакцинацию, не протестировав новую вакцину годами. Насколько обоснованы эти опасения и нужно ли, действительно, «придержать» новые вакцины, понаблюдав за привитыми добровольцами не менее года?
Наталья Востокова (НВ): Для оценки эффективности и безопасности вакцины против COVID-19 ВОЗ разработала руководство по проведению клинического исследования фазы III. Оно обязательно должно иметь двойной слепой плацебо-контролируемый дизайн. В качестве основной оценки (первичной конечной точки) используется частота случаев COVID-19 у добровольцев, получивших исследуемую вакцину или плацебо. Нужно понимать, что ни одна вакцина не может обладать 100%-ной эффективностью у всех людей, поэтому эффективность вакцинации оценивается по частоте снижения заболеваемости по сравнению с группой плацебо.
Недавно директор Центра оценки и исследований биологических препаратов FDA (CBER) Питер Маркс заявил, что у FDA нет каких-либо научных аргументов в пользу требования минимальной эффективности будущих вакцин в 50%. Если граница будет ниже, вакцина вряд ли будет эффективной. Если же планкой станет порог в 70–80%, который как раз необходим для ликвидации вируса при охвате прививками минимум 70% населения планеты, не факт, что уже разработанные вакцины до нее «дотянутся». На основании этого Маркс считает, что в каждую группу клинического исследования необходимо включить не менее 10–15 тыс. человек.
При включении достаточного количества добровольцев на фоне активного распространения инфекции трех-шести месяцев наблюдения будет достаточно для проведения оценки. Вакцина будет считаться эффективной, если у привитых участников заболеваемость COVID-19 будет наблюдаться в два раза реже, чем у непривитых, то есть из 150 заболевших соотношение добровольцев, получивших вакцину или плацебо, будет 50:100 (или менее). Конечно, все мы надеемся, что эффективная вакцина сможет полностью предотвратить передачу инфекции в обществе, и именно поэтому нужно, чтобы подавляющее большинство людей было привито, иначе даже эффективная вакцина не позволит достичь этой цели.
АР: Уместно ли с точки зрения безопасности вакцины сэкономить время, запустив испытания не друг за другом, а параллельно (например, исследования фазы II начать всего лишь на пару недель раньше фазы III)?
НВ: Цель фазы II — подобрать дозу и оптимальную схему вакцинации, которая позволит выработать стойкий иммунитет. Для этого оценивают разные параметры иммуногенности вакцины в определенные временные промежутки (в частности, как меняется титр антител со временем). Иммунная система разных людей по-разному отвечает на вакцинацию, поэтому дизайн исследования должен быть двойным слепым плацебо-контролируемым, чтобы отличить вариабельность иммунного ответа в рамках каждой схемы вакцинации от значимых различий между ними. Таким образом выбирают оптимальную схему для дальнейшего ее изучения в клиническом исследовании фазы III — ведь даже потенциально эффективная вакцина не будет работать, если доза и схема вакцинации подобраны неправильно. Такая предварительная оценка занимает от нескольких недель до нескольких месяцев и может начаться уже на этапе первого применения вакцины у добровольцев в рамках фазы I.
Что касается безопасности, то она оценивается на всех этапах клинической разработки вакцины и является ключевым фактором для принятия решений о ее дальнейшем изучении или регистрации. В рекомендациях ВОЗ по разработке вакцины против COVID-19 основным периодом сбора информации о побочных явлениях обозначены первые 14 дней после вакцинации (однако данные о безопасности собираются дольше — до 28 дней ). При этом в оценке безопасности помимо возможных нежелательных реакций важно изучить и риск непреднамеренного увеличения частоты возникновения или тяжести течения COVID-19 у привитых. Для такой оценки ВОЗ рекомендует использовать Независимый комитет по мониторингу данных, который на регулярной основе должен оценивать случаи COVID-19 у добровольцев, получивших исследуемую вакцину или плацебо.
Это минимальные сроки наблюдения — в НИИ им. Гамалеи собираются наблюдать за добровольцами полгода.
Как проходят клинические исследования вакцин
Многие представляют себе клинические исследования примерно так: есть вакцина ХХХ, сначала ее тестируют в лаборатории, потом — на животных (доклинические исследования, в которых используют разные дозировки, оценивая иммуногенность и безопасность), потом приходит очередь исследований на людях: набирают добровольцев, делают им прививки, платят какие-то деньги и проверяют титр антител. Однако в реальности дело обстоит немного иначе.
Фазы исследований
Кто может участвовать в клиническом исследовании?
Критерии отбора добровольцев регламентируются протоколом исследования и зависят от того, в какой группе населения будет применяться данная вакцина. Вполне возможно, что вакцины против коронавируса сначала будут одобрены для вакцинации здоровых взрослых, поэтому приведу требования для таких исследований:
Кто не может участвовать в клиническом исследовании?
Организационные вопросы
«Скороспелая» разработка
Из-за крайне сжатых сроков у многих складывается впечатление, что вакцины появились слишком быстро. Однако чтобы делать выводы о скорости, необходимо хорошо разбираться в процессах разработки, проверки и производства, иначе эти рассуждения переходят в разряд досужих рассуждений, не имеющих под собой никакой серьезной основы.
Почему вакцины разработали так быстро?
Если в двух словах, то векторные и мРНК-вакцины, которые сейчас тестируют на добровольцах, требуют небольших временных затрат, так как их «начинкой» является геном (мРНК вообще считается одной из самых простых конструкций [30]). Производителю не нужно тратить время на получение вакцинного штамма, его ослабление, культивирование или инактивацию. Поэтому как только в январе 2020 года был расшифрован геном SARS-CoV-2, появилась возможность начать работу над этими вакцинами. Также на скорость влияет наличие у производителя «платформы». Например, в НИИ им. Гамалеи делают векторную вакцину на платформе, которая была использована для производства векторных вакцин против лихорадки Эбола и MERS. НИЦ полиомиелита и вирусных энцефалитов им. М.П. Чумакова разрабатывает цельновирионную инактивированную вакцину, так как специализируется на производстве таких типов вакцин (вакцины против клещевого энцефалита и бешенства). И еще один немаловажный момент: в разработку вакцины против коронавируса инвестируется очень много денег, поэтому у многих производителей нет проблем с финансированием.
Будет ли массовая вакцинация осенью?
Несмотря на то, что в США надеются зарегистрировать мРНК-вакцину в конце 2020 года, в данный момент массовые прививки осенью и даже ранней зимой звучат слишком оптимистично. Производителям нужно не только успеть закончить все исследования на добровольцах и подготовить полный комплект документов для регистрации, но и произвести необходимое количество доз. А с этим проблемы: чтобы привить большинство населения России (про мир я даже не заикаюсь), необходимо минимум 100 миллионов доз. При этом производственные мощности отечественных фармкомпаний — 5–7 миллионов доз разных вакцин в месяц. К тому же нельзя перепрофилировать под коронавирус все производственные линии — мы останемся без прививок от других, более опасных заболеваний. Так что в перспективы скорой массовой вакцинации верится с трудом.
По словам Министра здравоохранения РФ Михаила Мурашко, «. медицинские работники и учителя станут первыми, кому сделают прививки от коронавирусной инфекции препаратом, разработанным центром», при этом наблюдения за привитыми добровольцами продолжатся. III фаза клинических исследований препарата должна начаться в августе.
Возможно ли, что новые вакцины будут опасны для привитых, как было с вакциной против лихорадки денге?
Мне кажется, историю с денге вспоминают для того, чтобы всех напугать, но я не стала бы ставить знак равенства между этими болезнями и вакцинами против них — они слишком разные. Лихорадка денге — очень распространенное заболевание и, в отличие от SARS-CoV-2, передается через укусы комаров. В той или иной форме ею ежегодно болеют сотни миллионов людей в мире, а смертность может достигать 2,5%. На данный момент против лихорадки денге существует только живая вакцина Dengvaxia от Sanofi. Прививают ее с девятилетнего возраста и лишь тем, кто уже переболел: у серопозитивных к денге эффективность вакцинации составляет 78,2%, у негативных — 52,5%.
Под антителозависимым усилением инфекции подразумевают ситуацию, когда антитела, связывающиеся с вирусом, не блокируют его, а наоборот, «помогают» заражать клетки. В первую очередь ADE касается не прививок, а некоторых вирусных заболеваний (в том числе и коронавирусных), возбудители которых заражают макрофаги и размножаются в них, что провоцирует системную воспалительную реакцию.
Что касается утяжеления болезни и летальных исходов у привитых, то данные об их количестве разнятся в зависимости от источника: во время массовой вакцинации на Филиппинах и в Бразилии в системе по наблюдению за побочными эффектами Sanofi были сообщения о 51 смерти, в 15 из которых причиной была лихорадка денге. Рассмотрев 14 из них, Глобальный консультативный комитет ВОЗ по безопасности вакцин не смог установить причинно-следственную связь с вакциной, назвав эти случаи «неопределенными» [32]. Тем не менее некоторые СМИ упоминают о более чем 600 погибших привитых филиппинских детях — к сожалению, без ссылок на расследования или какие-либо другие факты, заслуживающие доверия. Тут конфликт: с одной стороны официальные данные, которые могут не отражать реальной ситуации, с другой — жадные до сенсации СМИ и врачи, видящие в любой проблеме у привитых «страшное влияние вакцины». Стоит ли безоговорочно верить любому из этих источников, каждый решает сам, но вот информация к размышлению:
Теперь вернемся к коронавирусу и вакцинам против него. Во-первых, в данный момент нет точных сведений, что при COVID-19 у людей характерно антителозависимое усиление инфекции — есть косвенные признаки, которые могут свидетельствовать в его пользу, но в то же время они могут ничего не значить. На основании того, что известно сейчас, ADE при SARS-CoV-2 маловероятен, так как нет сообщений об утяжелении болезни пациентов, пролеченных сывороткой [33], [34], также не отмечалось усиления инфекции у макак, которых повторно заражали вирусом [35]. Во-вторых, разрабатываемые вакцины тестируют на животных на предмет утяжеления инфекции — если оно возникает, дальше доклинических исследований эта разработка не идет. В-третьих, для того и проводят клинические исследования на добровольцах, чтобы выяснить подобные аспекты. Подвох может быть в том, что ADE возникнет через несколько лет после выздоровления или вакцинации, но эта опасность в большей степени будет касаться переболевших, да и срок защиты прививки может быть короче этого времени, поэтому сейчас поводов для паники в отношении вакцин нет.
Какие проблемы могут возникнуть с этими вакцинами?
15 августа — День независимости Индии.
Научный мир Индии был в ярости: президент Индийской академии наук заявил СМИ, что сроки, озвученные ICMR, «неслыханны» и «обеспечат дурную славу» индийской фарминдустрии (которую и так постоянно критикуют). Позже ICMR оправдывались, что их «неправильно поняли»: 15 августа не было финальной датой, и, вообще, это было лишь попыткой сократить бумажную волокиту, а не сроки клинических исследований. Но, как говорится, осадок остался.
Не менее серьезные события происходят в США: во время празднования Дня независимости (4 июля) президент Трамп заявил, что вакцина будет готова «задолго до конца года». Однако глава FDA Стивен Хан менее оптимистичен: «Я не могу предсказать, когда она будет доступна», — сообщил он СМИ, добавив, что разработка и исследования будут основаны на «фактических данных и науке».
Так как не известна длительность иммунитета после перенесенного COVID-19 и эффективность в защите против повторного заболевания, то точно такая же проблема существует и для переболевших.
И наконец могут возникнуть трудности, связанные с производством необходимого количества доз, транспортировкой и хранением этих вакцин. Но если производство можно худо-бедно наладить, переориентировав несколько фармкомпаний мира только под эти препараты, то с транспортировкой и хранением может случиться провал. Если вакцина будет требовать, скажем, очень низких температур хранения, появится проблема с вакцинацией в жарком климате и странах/регионах мира, где нет постоянного электроснабжения. Это довольно серьезно: именно проблемы с электричеством, не позволяющие хранить вакцину против лихорадки Эбола при температурах от −60 до −80 °C, крайне затрудняют программу вакцинации в Демократической Республике Конго [36], в которой полыхает уже 11-я вспышка этой инфекции.
Зачем нужна вакцина, если коронавирус постоянно мутирует?
Честно говоря, непонятно, на каких основаниях диванные «вирусологи» считают SARS-CoV-2 «постоянно мутирующим». Возможно, они путают его с вирусом гриппа, возможно — ищут «вескую причину», чтобы отказаться от прививок. В любом случае, мутации не являются чем-то особенным — они помогают возбудителям лучше приспосабливаться к меняющимся условиям окружающей среды, но это не обязательно влияет на эффективность вакцинации. Например, вирус кори, у которого насчитывается более 30 генотипов, уже более 50 лет прививают вакцинами на основе одного из шести полученных довольно-таки давно вакцинных штаммов (Edmonston-B, Schwarz, Edmonston-Zagreb, Moraten, Ленинград-16 и Шанхай-191). При этом антигенный состав вакцин против гриппа приходится менять каждый год.
Коронавирусы считаются относительно стабильными, и это дает надежду на разработку эффективной вакцины. Во время исследований штаммов SARS-CoV-2 весной 2020 года выяснилось, что в среднем для них характерны примерно 2 мутации в месяц. Это мало. Правда, в последнее время появляются данные, что, возможно, свойства вируса все-таки немного изменились, и он стал менее патогенным [37]. Однако у этой версии много противников: в июне 2020 года ВОЗ в лице руководителя по реагированию на COVID-19 Марии Ван Керхове назвала эти предположения «не подтвержденными научными данными». По ее словам, «нет никаких данных, свидетельствующих о том, что новый коронавирус значительно меняется, ни в отношении передачи, ни в степени тяжести заболевания». Этой же точки зрения придерживается Франсуа Баллу, профессор и директор Института генетики Лондонского университетского колледжа (UCL): «Генетический состав вирусной популяции фактически не сильно изменился с момента его появления». Ему вторят авторы препринта исследования Making sense of mutation: what D614G means for the COVID-19 pandemic remains unclear [38], которые изучили аминокислотную мутацию D614G S-белка коронавируса и считают, что «. глобальное распространения вируса с мутацией G614, приобретенной посредством естественного отбора или случайно, означает, что именно он и является пандемичным штаммом (. ) Хотя мутация D614G находится во внешнем белке вируса, к которому формируется иммунитет, и теоретически может влиять на эффективность вакцинации, вероятность этого мала. D614G находится не в рецептор-связывающем домене (RBD) S-белка, а на границе раздела между отдельными протомерами-шипами, которые связывают их в единую форму на поверхности вириона с помощью водородных связей». В общем, делать окончательные выводы пока рано, но маловероятно, что SARS-CoV-2 в ближайшее время вдруг резко мутирует.
Подводя итог, хочу сказать: «Не читайте по утрам советских газет». Это сбережет нервы и избавит от лишних страхов. СМИ слишком падки на сенсации, поэтому публикуют много противоречивой и непроверенной информации. Сейчас даже среди экспертов ведутся постоянные споры, что уж говорить о журналистах! Конечно, то, что до сих пор нет ни одной одобренной для применения у людей РНК-вакцины, и вдруг ее разработали буквально за считанные месяцы, может внушать определенные опасения. Однако что в этом такого удивительного? Современные технологии и хорошее финансирование позволяют создать вакцину в сжатые сроки, поэтому не так важно, за сколько недель ее создали — важно, чтобы ее качественно исследовали на большом количестве добровольцев.
Требования к безопасности вакцин сейчас очень высокие — я не удивлюсь, если подтверждение о вакцинации будут требовать при пересечении границы или для работы в офисе. Так что на карту поставлен не только престиж фармкомпаний: ни производителям, ни регуляторам не выгодно начинать прививки непроверенной вакциной — это подорвет доверие к вакцинации, и так сильно пошатнувшееся из-за антипрививочного движения. Поэтому прежде, чем искать повод избежать прививок, взвесьте риски: вакцины не вызывают пневмонию или фиброз легких, они не кардиотоксичны, как противомалярийные препараты, и, боюсь, как бы в ближайшее время не выяснилось, что последствия для здоровья после перенесенного COVID-19 затмевают все страхи в отношении вакцин. В конце концов, предотвратить болезнь всегда надежнее, чем бороться с ее последствиями.
Автор благодарит PhD, доцента, руководителя курса прикладной фармакологии и фармакотерапии в университете OsloMet (Норвегия) и руководителя международных проектов по безопасности пациентов и персонализированной медицине Юрия Киселева и специалиста по регуляторным вопросам и разработке лекарств Центра научного консультирования Равиля Ниязова за помощь в подготовке материала.