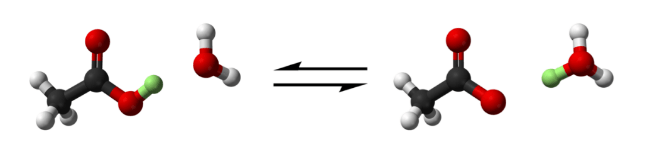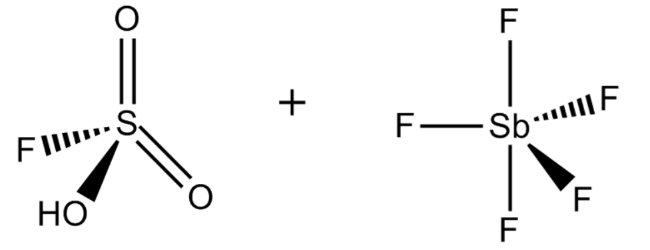что такое безводная кислота
Что такое уратные камни при МКБ и как их лечить
Уратные камни в почках встречаются у 5-15% всех больных мочекаменной болезнью. Многие сталкиваются с этой проблемой, поэтому в нашей статье сегодня мы подробно разберём причины появления мочекислых камней, диагностику и лечение этого вида МКБ.
Что такое «уратный камень»?
Уратными называют камни, которые формируются из мочевой кислоты и ее солей (преимущественно натриевой и калиевой). Образования имеют желто-оранжевый или кирпичный цвет, ровную, гладкую поверхность.
Если появляется уратный камень, причина возникновения, как правило, одна: нарушение работы почек. Дело в том, что моча человека представляет собой раствор солей. Чтобы она не кристаллизовалась, организм вырабатывает гликопротеиды. Если эта функция нарушена, соли в моче начинают оседать, образовываются камни. Также этому процессу способствует общее закисление мочи.
С точки зрения пациента образование уратных камней в почках провоцирует неправильное питание: слишком большое количество мяса, субпродуктов, белковой пищи в рационе, малое количество потребляемой жидкости. Повысить риск может также нарушение обмена веществ и ожирение.
Как определить наличие уратных камней
Диагностика уратных камней часто затруднена из-за их состава. Малая плотность образований не даёт им проявляться на рентгеновских снимках. Поэтому их определяют с помощью УЗИ или после анализа мочи.
Подагра может быть косвенным признаком развития уратных камней. Оба заболевания вызываются одними факторами, поэтому при обнаружении одного сразу же проверяют и на второе.
Пациент не может почувствовать, как образуются уратные камни в почках, но заметит такие симптомы:
Лечение уратных камней в почках нужно начинать незамедлительно, тогда от них можно избавиться без хирургического вмешательства.
Основы терапии
Уратные камни — единственный вид образований в почках, подвергающийся растворению. Их можно вывести из организма естественным путем. Для этого используется медикаментозная терапия и специальная диета.
Лекарства от камней в почках
Так как растворить уратные камни в почках нужно быстро, врачи назначают пациентам соответствующие препараты. Это могут быть:
Самостоятельно их покупать себе нельзя, важно чтобы врач определил схему лечения и дозировку. Но можно скорректировать диету.
Режим питания
При уратных камнях правильное питание — основа лечения, поэтому ему нужно уделить максимум внимания. Перечислим, что можно есть при уратных камнях:
Минеральная вода при уратных камнях прописывается щелочная.
Главная задача лечебного меню — обеспечить ощелачивание мочи. Вторая цель — остановить накопление солей. Поэтому из рациона потребуется исключить часть продуктов.
Что нельзя есть при уратных камнях:
Также некоторые продукты питания необходимо ограничить. Полный список запретов выдает врач.
Помните, при уратных камнях наиболее эффективны комплексные подходы. Поэтому не стоит самостоятельно лечиться только диетой или отварами трав. Консультации врача и диагностика помогут победить проблему.
Не знаете, куда обратиться? Клиника урологии имени Р. М. Фронштейна готова принять вас и обеспечить консультацию. Наши специалисты соберут анамнез, направят на все необходимые анализы и назначат корректное лечение. Звоните и записывайтесь на прием, мы всегда рады помочь!
8 сильнейших кислот, известных нам
Что делает кислоту сильной или слабой? Чтобы ответить на этот вопрос, нам сначала нужно взглянуть на определение кислоты. Это химическое соединение, которое принимает электроны и / или отдает (диссоциирует) ионы водорода, также известные как протоны.
Следовательно, уровни кислотности кислоты зависят от ее способности диссоциировать ионы водорода, т.е. чем больше число ионов водорода, продуцируемых кислотой в растворе, тем более кислым он является. Теперь, прежде чем мы перейдем к списку сильнейших кислот на Земле, есть определенные термины и определения, с которыми вам необходимо ознакомиться.
Это подводит нас к другому связанному и важному показателю кислотности pKa. Это в основном отрицательный целочисленный логарифм Ka.
Чем сильнее кислота, тем ниже значения pKa.
Уксусная кислота отдает протон (в зеленом цвете) воде, чтобы произвести ион гидрония и ион ацетата. (Кислород в красном, водород в белом и углерод в черном)
Функция кислотности Гаммета: (H o) Всем нам известна шкала pH, которая обычно используется для измерения уровней кислотности или основности химических веществ, но когда речь идет о суперкислотах, она просто становится бесполезной, поскольку их уровни кислотности в миллион раз больше, чем серная и соляная кислоты.
Таким образом, чтобы измерить суперкислоты на основе их уровней кислотности, исследователи придумали функцию кислотности Гаммета. Первоначально он был предложен американским физическим химиком Луи Плаком Гаммет.
8. Серная кислота
Серная кислота (98%) на листе бумаги
Серная кислота или купорос не нуждаются в формальном введении. Он не имеет запаха, цвета и вызывает интенсивную экзотермическую реакцию при смешивании с водой. Серная кислота является важным химическим веществом, которое необходимо для многих отраслей промышленности, таких как сельское хозяйство, очистка сточных вод и нефтепереработка. Она также используется в кислотах аккумулятора и чистящих средствах.
Она также играет важную роль в изучении кислот в целом. Серная кислота служит базовым эталоном для сравнения уровней кислотности суперкислот или кислот. Хотя существует несколько способов получения серной кислоты, обычно используют контактный процесс и влажный процесс серной кислоты.
H 2 SO 4 может нанести значительный ущерб коже человека при прямом контакте. Это также очень разъедает многие металлы. Химическое вещество гораздо более агрессивно и опасно, когда присутствует в высокой концентрации, благодаря своим превосходным окислительным и дегидратирующим свойствам.
7. Соляная кислота
Подобно серной кислоте, соляная кислота также является важным химическим веществом, которое широко используется в лабораториях и различных отраслях промышленности. Соляная кислота была обнаружена где-то около 800 г. н.э. иранским ученым-эрудитом по имени Джабир ибн Хайян.
Те, кто задаются вопросом, почему соляная кислота сильнее серной кислоты, несмотря на то, что последняя является контрольной точкой для суперкислот, причина этого заключается в том, что серная кислота является дипротоновой кислотой, которая обычно не полностью диссоциирует.
Другими словами, HCl сильнее серной кислоты, поскольку ее ионы водорода (HCl) легко отделяются от хлорида по сравнению с сульфат-ионом из серной кислоты. Так или иначе, соляная кислота в основном используется в тяжелой промышленности для удаления ржавчины с железа и стали перед дальнейшей обработкой. Кроме того, это жизненно важный компонент в производстве органических (винилхлорид используется для ПВХ) и многих неорганических соединений.
6. Трифторметансульфоновая кислота
Трифликовая кислота используется во многих протонированиях и титрованиях (количественный анализ химического состава). Важная причина, по которой трифликовая кислота является предпочтительной в определенных случаях, заключается в том, что она не сульфонирует другие вещества, что характерно для хлорсульфоновой кислоты и серной кислоты.
Излишне говорить, что это чрезвычайно опасно. Любой контакт кожи с кислотой может вызвать серьезные ожоги и может привести к незначительному повреждению тканей. Это может также вызвать отек легких и судороги и другие критические условия при вдыхании.
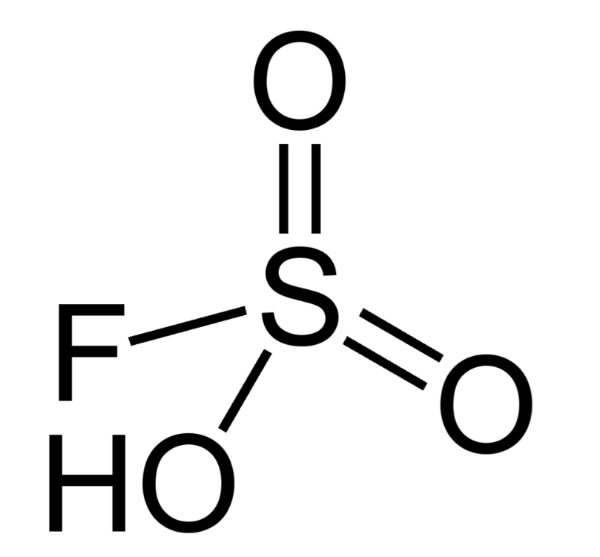
5. Фторсульфоновая кислота
Фторосерная кислота или серно-фтористоводородная кислота (официальное название) является второй сильнейшей однокомпонентной кислотой, доступной сегодня. Это желтый на вид и, конечно, очень едкий / токсичный. HSO 3 F обычно получают путем взаимодействия фтористого водорода с триоксидом серы, и в сочетании с пентафторидом сурьмы он образует «волшебную кислоту», гораздо более сильную кислоту и протонирующий агент.
Кислота может быть использована для алкилирования углеводородов (с алкенами) и изомеризации алканов, а также для травления стекла (художественное стекло). Это обычный фторирующий агент в лабораториях.
4. Хлорная кислота
Хлорная кислота является одной из самых сильных кислот Бренстеда-Лоури, которые обладают сильными окислительными свойствами и обладают высокой коррозионной активностью. Традиционно ее получают обработкой перхлората натрия соляной кислотой (HCl), которая также создает хлорид натрия.
NaClO4 + HCl → NaCl + HClO4
В отличие от других кислот, хлорная кислота не подвержена гидролизу. Это также одна из самых регулируемых кислот в мире. Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек получили ранения и 17 человек погибли в результате химического взрыва, в котором содержалось почти 75% хлорной кислоты (по объему) и 25% ангидрида уксусной кислоты. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Несмотря на взрывную природу, хлорная кислота широко используется и даже предпочтительна в некоторых типах синтеза. Это также важный компонент перхлората аммония, который используется в современном ракетном топливе.
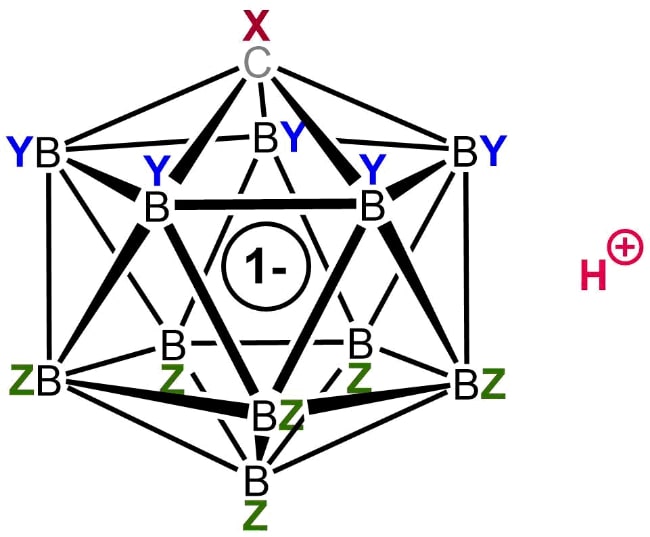
3. Фторированная карборановая кислота
Общая структура карбоновой кислоты
Одним из таких членов этой группы является фторированная карборановая кислота. Хотя о существовании такого химического вещества первоначально сообщалось в 2007 году, исследователи смогли в полной мере изучить его природу только в 2013 году. До его открытия корона сильнейшей кислоты Бренстеда перешла к сильно хлорированной версии этого семейства суперкислот.
Фторированный карборан является единственной известной кислотой, которая может протонировать (переносить ион водорода) диоксид углерода с образованием катионов, соединенных водородом. В отличие от этого, CO 2 не подвергается какой-либо заметной протонации при обработке другими суперкислотами, такими как магическая кислота и HF-SbF5.
2. Волшебная кислота
FSO 3 H · SbF 5, наиболее известный как магическая кислота, получают смешением фторсерной кислоты и пентафторида сурьмы в молярном соотношении 1: 1. Эта сверхкислотная система была впервые разработана в 1966 году исследователями из лаборатории Джорджа Олаха, Университета Case Western Reserve в Огайо.
Его довольно причудливое название было установлено после официального события в 1966 году, когда сотрудник лаборатории Олаха продемонстрировал протонирование углеводородов, в котором парафиновая свеча «волшебным образом» растворилась и превратилась в раствор трет-бутильного катиона после того, как она была помещена в то, что сейчас известно как волшебная кислота.
Хотя Волшебная кислота обычно используется для стабилизации ионов углерода в растворах, она имеет несколько других важных промышленных применений. Например, он может ускорить изомеризацию насыщенных углеводородов и даже протоната метана, ксенона и галогенов, которые все являются слабыми основаниями.
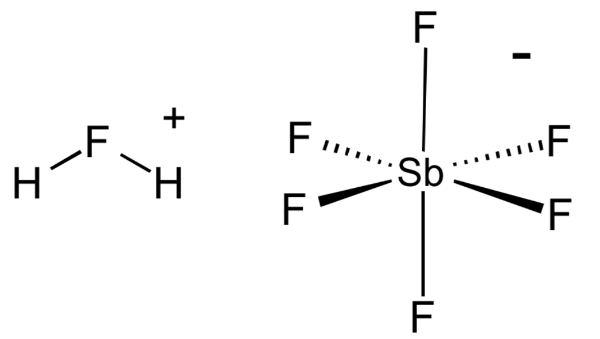
1. Фтороантимоновая кислота
Фторантимоновая кислота является, пожалуй, самой сильной из всех известных суперкислот, основанных на значениях функции кислотности Гаммета. Его получают путем смешивания фтористого водорода с пентафторидом сурьмы, как правило, в соотношении 2: 1. Эта реакция носит экзотермический характер.
Этот суперкислота имеет несколько важных применений в химическом машиностроении и нефтехимической промышленности. Например, его можно использовать для отделения метана и Н 2 от неопентана и изобутана (оба алкана) соответственно.
Неудивительно, что H 2 FSbF 6 чрезвычайно агрессивен и может подвергаться сильному гидролизу при контакте с водой. Как и большинство суперкислот, фторантимоновая кислота может питаться прямо через стекло, поэтому она должна храниться в контейнерах из политетрафторэтилена.
Теперь, большинство из вас, возможно, наткнулись на карбоновые кислоты (либо хлорированная карбоновая кислота, либо фторированная карборановая кислота), когда искали «самые сильные кислоты в мире». Ну, технически они верны, так как карбоновые кислоты являются самыми сильными известными однокомпонентными кислотами на Земле, гораздо более кислыми, чем подобные хлорной и трифликовой кислотам (фтороантимоновая кислота на самом деле является смешанной кислотой).
Виды кислот и способы их получения
В химии неорганические соединения делятся на простые и сложные вещества. Простые состоят из атомов одного химического элемента, сложные — из нескольких. Сложные неорганические вещества делятся на пять основных классов: кислоты, основания, амфотерные гидроксиды, оксиды, соли.
Разберёмся с первым классом из списка — кислотами.
Что такое кислота — определение в химии
Кислоты — это сложные вещества, которые состоят из атомов водорода и кислотных остатков.
A c — кислотный остаток;
x — число атомов водорода;
n — степень окисления кислотного остатка.
В химических реакциях активный атом водорода может замещаться на атом металла, в результате чего получается соль. Кислотный остаток — это часть молекулы кислоты без атомов водорода. Валентность кислотного остатка равна числу связанных с ним атомов водорода.
Виды кислот и их классификация, какие бывают (примеры)
Существуют несколько классификаций кислот. Разберёмся с основной классификацией, созданной по формальным признакам: содержанию кислорода, растворимости и так далее.
По содержанию кислорода
Кислоты могут делиться на кислородосодержащие и бескислородные.
Кислородсодержащие получаются при воздействии воды на кислотные оксиды — ангидриды.
Их название в корне содержит название элемента, входящего в состав ангидрида. Примеры:
Номенклатура выглядит следующим образом. В случае, если элементу соответствуют несколько кислот, для названия кислоты с большей валентностью такого элемента употребляют суффикс «Н» или «В». Для кислот с меньшей валентностью элемента в названиях добавляют еще один суффикс «ИСТ». Например, серная ( H 2 S O 4 ) и сернистая кислота ( H 2 S O 3 ).
Бескислородные представляют собой растворы некоторых газов в воде. Названия бескислородных кислот составляют по принципу: элемент + водородная кислота.
Важно, что газ и раствор газа имеют различные свойства. Например, хлороводород и соляная кислота.
Газ хлороводород можно получить из водорода и хлора. Уравнение:
H 2 + C l 2 → 2 H C l
В сухом состоянии такой газ не проявляет кислотных свойств. При перевозке в тех же металлических ёмкостях не происходит никаких реакций. Но, если хлороводород растворить в воде, получается раствор, который называют соляной кислотой. Она обладает сильными кислотными свойствами и опасна при реагировании с металлом.
По растворимости в воде
Кислоты делят на растворимые и нерастворимые. Большинство кислот растворимы. Нерастворимые — кремниевая H 2 S i O 3 и все органические карбоновые кислоты, содержащие десять атомов углерода и больше.
По летучести
Летучие кислоты — это химические соединения, которые быстро испаряются при нормальных условиях, то есть молекулы легко переходят в газовую фазу. В их список входят, к примеру, органические соединения, которые образуются в человеческом организме в результате процесса пищеварения, болезней или метаболизма.
Список летучих кислот:
Нелетучими являются все остальные. Они стабильны в водных растворах.
По силе (степени диссоциации)
Кислоты также можно разделить на сильные и слабые. Если в водном растворе кислота полностью распадается на ионы (диссоциирует), то она является сильной. Слабые кислоты не распадаются на ионы полностью, обычно их диссоциация протекает в незначительной степени.
Как определить силу кислоты, то есть степень диссоциации? Можно использовать лёгкий приём: вычесть из числа атомов O число атомов H. Если в ответе получается число меньше 2 — слабая. Больше или равно — сильная.
Степень диссициации можно также установить экспериментальным путем посредством измерения проводимости растворов. Разбавленные растворы сильных кислот хорошо проводят электрический ток, растворы слабых кислот — плохо.
Характерные химические и физические свойства
Химические свойства
Взаимодействие с основными оксидами. Образуются соль и вода:
C a O + 2 H C l → C a C l 2 + H 2 O
Взаимодействие с амфотерными оксидами. Образуются соль и вода:
Z n O + 2 H N O 3 → Z n ( N O 3 ) 2 + H 2 O
Взаимодействие со щелочами. Образуются соль и вода (реакция нейтрализации):
N a O H + H C l → N a C l + H 2 O
Взаимодействие с солями. Реакция протекает, если выпадает осадок или выделяется газ:
B a C l 2 + H 2 S O 4 → B a S O 4 ↓ + H C l ↑
Сильные кислоты вытесняют более слабые из их солей:
K 3 P O 4 + 3 H C l → 3 K C l + H 3 P O 4
Также металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (если соль, которая образуется в итоге, растворима):
M g + 2 H C l → M g C l 2 + H 2 ↑
Однако! С азотной и концентрированной серной кислотами реакция идёт иначе:
M g + 2 H 2 S O 4 → M g S O 4 + S O 2 ↑ + 2 H 2
Физические свойства
Получение и применение кислот
Кислоты можно получить несколькими методами.
Взаимодействие кислотного оксида с водой:
H 2 O + S O 3 → H 2 S O 4
Взаимодействие водорода и неметалла:
H 2 + C l 2 → 2 H C l
Вытеснение слабой кислоты из солей более сильной кислотой:
3 H 2 S O 4 + 2 K 3 P O 4 → 3 K 2 S O 4 + H 3 P O 4
Кислоты находят широкое применение в различных сферах. К примеру, серная используется для производства лакокрасочных материалов и минеральных удобрений. Борная является медицинским антисептиком. Уксусную и лимонную добавляют при приготовлении выпечки, а аскорбиновую применяют при лечении простудных заболеваний.
Кислоты. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н + (или Н3О + ).
Получение кислот
1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
При этом оксид кремния (IV) с водой не реагирует:
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
H2 0 + Cl2 0 → 2 H + Cl —
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Химические свойства кислот
1. В водных растворах кислоты диссоциируют на катионы водорода Н + и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
HCl → H + + Cl –
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H2O → H3O + + Cl –
Многоосновные кислоты диссоциируют cтупенчато.
HSO3 – ↔ H + + SO3 2–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
4H I — + 2 Cu +2 Cl2 → 4HCl + 2 Cu + I + I2 0
6. Кислоты взаимодействуют с солями.
Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода
Ag + NO3 — + H + Cl — → Ag + Cl — ↓ + H + NO3 —
7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
KHCO3 + HCl → KCl + CO2 + H2O
Ещё пример : гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Al (OH) Cl2 + HCl → AlCl3 + H2O
8. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:
При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H2↑
Fe + 2 H + Cl → Fe +2 Cl2 + H2 0
Сероводородная кислота H2S, угольная H2CO3, сернистая H2SO3 и кремниевая H2SiO3 с металлами не взаимодействуют.
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
9. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
Азотная кислота HNO3 разлагается при нагревании или на свету: