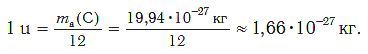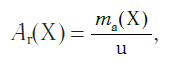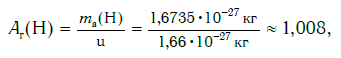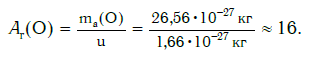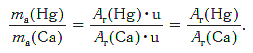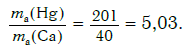что такое атомный вес
АТОМНЫЙ ВЕС
Полезное
Смотреть что такое «АТОМНЫЙ ВЕС» в других словарях:
АТОМНЫЙ ВЕС — АТОМНЫЙ ВЕС, прежнее название ОТНОСИТЕЛЬНОЙ АТОМНОЙ МАССЫ … Научно-технический энциклопедический словарь
АТОМНЫЙ ВЕС — (см. АТОМНАЯ МАССА). Физический энциклопедический словарь. М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1983 … Физическая энциклопедия
АТОМНЫЙ ВЕС — см. Атомная единица массы. Геологический словарь: в 2 х томах. М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978 … Геологическая энциклопедия
атомный вес — Единица массы химических элементов [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN atomic weight … Справочник технического переводчика
АТОМНЫЙ ВЕС — см … Большая политехническая энциклопедия
атомный вес — santykinė atominė masė statusas T sritis chemija apibrėžtis Vidutinės elemento atomų masės ir 1/12 nuklido ¹²C atomo masės santykis. atitikmenys: angl. atomic mass; atomic weight; relative atomic mass rus. атомная масса; атомный вес;… … Chemijos terminų aiškinamasis žodynas
Атомный вес — см. Атомная масса … Большая советская энциклопедия
Атомный вес — см. Веса атомные … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
АТОМНЫЙ ВЕС — см. Атомная масса … Большой энциклопедический политехнический словарь
Урок 2. Относительная атомная масса химических элементов
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
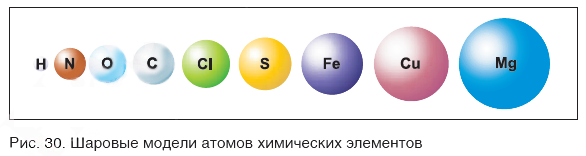
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
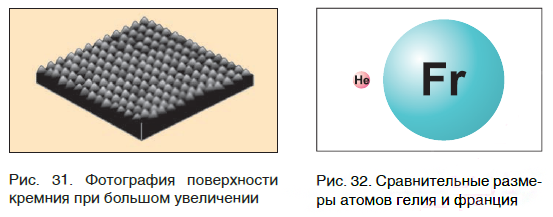
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10 −27 кг и 9,8·10 −10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10 −27 кг, а атома кислорода — ma(О) = 26,56·10 −27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10 −27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar ( А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах ( ma(O) = 26,56·10 −27 кг) или атомных единицах массы ( ma(O) = 16· u ).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Атомный вес: что это такое, как рассчитывается и примеры
Содержание:
Термин «вес» в физике означает силу, действующую на гравитационное поле, выраженную в единицах силы, таких как ньютон. Однако с 1908 года используется термин «атомная масса», который сегодня более известен как относительная атомная масса; то есть они синонимы.
Атомы настолько малы, многочисленны и различаются даже для одного и того же элемента, что непросто присвоить им физическую величину, например массу. Точно со временем выбор единицы, представляющей вес или атомную массу химического элемента, изменился.
С 1961 года из-за большого значения атома углерода (C) было решено относить атомный вес к его изотопу C-12. Кроме того, атом C является центральным или ключевым химическим элементом органической химии и биохимии.
Что такое атомный вес?
Как упоминалось в первом разделе, термин атомная масса традиционно используется, но на самом деле это атомная масса. С 1961 года на основе атома углерода-12 его значение 12 было принято за шкалу относительных атомных весов.
При сравнении это означает, что атомы Mg тяжелее атомов H: в 24 раза точнее. Когда требуются значения веса или атомной массы какого-либо химического элемента, их можно получить, обратившись к таблице Менделеева.
Единицы
Одна из первых единиц атомного веса, а.е.м., была выражена как 1/16 (0,0625) веса атома кислорода.
Эта единица изменилась с открытием существования природных изотопов элемента в 1912 году; поэтому изотопы больше нельзя было игнорировать.
В настоящее время стандартная единица атомной массы или дальтон составляет 1/12 веса атома изотопа 12 C. Это более стабильно и обильнее, чем 13 C и 14 С.
Таким образом, относительный атомный вес или атомная масса в настоящее время может быть выражена в граммах на один моль атомов.
Как рассчитывается атомный вес?
Чтобы определить атомный вес, сначала необходимо вычислить атомную массу изотопа, которая является суммой количества протонов и нейтронов, имеющихся у определенного атома.
Количество электронов в нем не учитывается, так как его масса ничтожна по сравнению с массой нейтронов и протонов.
56 (0,93) + 54 (0,05) + 57 (0,02) = 55,92 г / моль атомов Fe
В этом кластере железо имеет атомный вес 55,92. Но как насчет остальной части всей планеты Земля или остальной Вселенной? В кластере всего три изотопа, содержание которых меняется с учетом Земли, где изотопов будет больше и расчеты усложняются.
Соображения
Чтобы рассчитать атомный вес элементов, указанных в периодической таблице, необходимо принять во внимание следующее:
-Изотопы, существующие в природе одного и того же химического элемента. Атомы одного и того же химического элемента с разным числом нейтронов являются изотопами этого химического элемента.
-В образцах, полученных от каждого изотопа, учитывается атомная масса каждого из них.
-Относительное содержание каждого из изотопов определенного элемента в образцах, встречающихся в природе, также имеет значение.
-Можно найти значение атомной массы отдельного атома или присутствующего в естественном образце элемента. Или группы атомов в случае изотопов одного и того же элемента, определяя стандартный или средний атомный вес.
-Для определения стандартной атомной массы химических элементов были рассмотрены один или несколько изотопов одного и того же элемента.
-Есть некоторые химические элементы, такие как франций (Fr), которые не имеют стабильных изотопов и еще не имеют стандартизованного атомного веса.
Примеры
Посмотрев на периодическую таблицу химических элементов, можно узнать атомный вес химического элемента; то есть те, которые были рассчитаны с учетом всех стабильных изотопов (и по этой причине они обычно имеют много десятичных знаков).
Для бора его атомный вес был определен на основе двух изотопов, полученных в природе, и его значение находится в диапазоне от 10,806 до 10821.
Не существует стандартного атомного веса для неприродных или синтетических элементов, не имеющих изотопов в природе; такие как вышеупомянутый случай франция (Fr), полония (Po), радона (Ra), среди других химических элементов.
В этих случаях атомный вес ограничивается суммой количества протонов и нейтронов этого элемента.
Значение атомного веса указано в скобках, что означает, что это не стандартизованный атомный вес. Даже значение стандартного атомного веса может измениться, если будет обнаружено больше изотопов определенного элемента.
Ссылки
Индустриальный ландшафт: характеристики, элементы и примеры
Молекулярная физика. Атомная единица массы. Атомная масса.
Атомная единица массы.
Атомная единица массы (а.е.м.) — единица массы, равная 1/12 массы атома изотопа углерода 12 С:
Чтобы перевести значение массы атомов или молекул, выраженной в а.е.м., т. е. относительную молекулярную (или атомную) массу вещества Mr, в единицу массы СИ (кг), пользуются формулой:

Относительная молекулярная масса (атомная масса) — относительное значение массы молекулы (атома), выраженное в атомных единицах массы:

где Mr — относительная молекулярная (атомная) масса; m0 — масса молекулы (атома), выраженная в единицах СИ (кг); m0С — масса молекулы изотопа углерода 12 С, выраженная в тех же единицах, что и m0.

Атомная масса была взята Д. И. Менделеевым за основную характеристику элемента при открытии им периодической системы элементов. Атомная масса — дробная величина, в отличие от массового числа — количества нуклонов в атоме.
Относительная молекулярная масса вещества складывается из относительных атомных масс (а.м.) входящих в молекулу элементов.
Атомные массы всех химических элементов точно измерены.
Атомная масса
А́томная ма́сса, относительная атомная масса (устаревшее название — атомный вес) — значение массы атома, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопа углерода 12 C, поэтому атомная масса этого изотопа по определению равна точно 12. Разность между атомной массой изотопа и его массовым числом называется избытком массы (обычно его выражают в МэВ). Он может быть как положительным, так и отрицательным; причина его возникновения — нелинейная зависимость энергии связи ядер от числа протонов и нейтронов, а также различие в массах протона и нейтрона.
Зависимость атомной массы изотопа от массового числа такова: избыток массы положителен у водорода-1, с ростом массового числа он уменьшается и становится отрицательным, пока не достигается минимум у железа-56, потом начинает расти и возрастает до положительных значений у тяжёлых нуклидов. Это соответствует тому, что деление ядер, более тяжёлых, чем железо, высвобождает энергию, тогда как деление лёгких ядер требует энергии. Напротив, слияние ядер легче железа высвобождает энергию, слияние же элементов тяжелее железа требует дополнительной энергии.
Атомная масса химического элемента (также «средняя атомная масса», «стандартная атомная масса») является средневзвешенной атомной массой всех стабильных изотопов данного химического элемента с учётом их природной распространённости в земной коре и атмосфере. Именно эта атомная масса представлена в периодической таблице Д. И. Менделеева, её используют в стехиометрических расчётах. Атомная масса элемента с нарушенным изотопным соотношением (например, обогащённого каким-либо изотопом) отличается от стандартной. Для моноизотопных элементов (таких как иод, золото и т. п.) атомная масса элемента совпадает с атомной массой его единственного представленного в природной смеси изотопа.
Молекулярной массой химического соединения называется сумма атомных масс элементов, составляющих её, умноженных на стехиометрические коэффициенты элементов по химической формуле соединения. Строго говоря, масса молекулы меньше массы составляющих её атомов на величину, равную энергии связи молекулы. Однако этот дефект массы на 9-10 порядков меньше массы молекулы, и им можно пренебречь.
Определение моля (и числа Авогадро) выбирается таким образом, чтобы масса одного моля вещества (молярная масса), выраженная в граммах, была численно равна атомной (или молекулярной) массе этого вещества. Например, атомная масса железа равна 55,847. Следовательно один моль железа (т. е. количество атомов железа, равное числу Авогадро, 6,022·10 23 ) имеет массу 55,847 г.
Прямое сравнение и измерение масс атомов и молекул выполняется с помощью масс-спектрометрических методов.
История
До 1960-х годов атомную массу определяли таким образом, чтобы нуклид кислород-16 имел атомную массу 16 (кислородная шкала). Однако соотношение кислорода-17 и кислорода-18 в природном кислороде, который также использовался в расчётах атомной массы, приводило к наличию двух разных таблиц атомных масс. Химики использовали шкалу, основанную на том, что естественная смесь изотопов кислорода должна была иметь атомную массу 16, тогда как физики присваивали то же число 16 атомной массе наиболее распространённого изотопа кислорода (имеющего восемь протонов и восемь нейтронов).