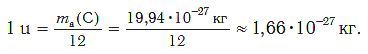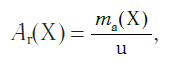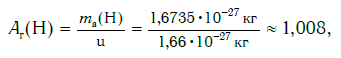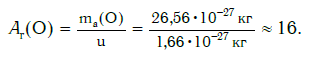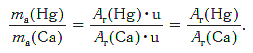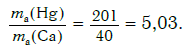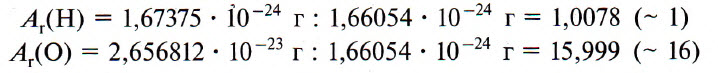что такое атомная масса в таблице менделеева
Урок 2. Относительная атомная масса химических элементов
В уроке 2 «Относительная атомная масса химических элементов» из курса «Химия для чайников» рассмотрим разные способы выражения массы химических элементов. Напоминаю, что в прошлом уроке «Атомы и химические элементы» мы рассмотрели, кто и когда высказал идею о том, что все вокруг состоит из атомов; также выяснили, что из себя представляет химический элемент и каким образом обозначается.
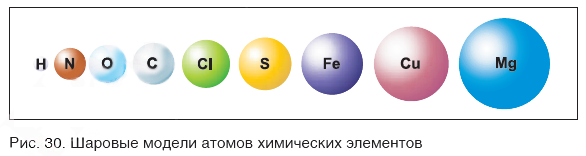
Чем различаются атомы разных элементов между собой? Вы уже знаете: массой, размерами и строением. На рисунке 30 показаны шаровые модели атомов некоторых химических элементов, конечно, не в реальных размерах, а многократно увеличенные. В действительности атомы настолько малы, что их невозможно рассмотреть даже в самые лучшие оптические микроскопы.
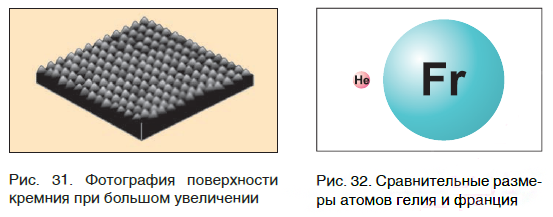
На заметку: В конце XX в. у ученых появились более совершенные микроскопы, позволяющие достигать увеличения в несколько десятков миллионов раз. Они называются туннельными микроскопами. На рисунке 31 показана фотография поверхности кремния. На ней отчетливо видны отдельные атомы, расположенные на поверхности этого вещества.
Размеры и масса атомов
Современная наука обладает методами, позволяющими определять размеры и массы атомов. Так, например, самый легкий атом — атом водорода. Его масса равна 0,0000000000000000000000000016735 кг. Самым маленьким является атом гелия He. Диаметр этого атома равен приблизительно 0,00000000098 м. Записывать и читать такие числа затруднительно, поэтому обычно их представляют в более удобном виде: 1,6735·10 −27 кг и 9,8·10 −10 м. Атомы большинства химических элементов по своим размерам значительно больше атома гелия. Самый большой из них — атом элемента франция Fr. Его диаметр в 7 раз больше диаметра атома гелия (рис. 32).
Еще больше различаются атомы разных элементов по массе. Масса атома обозначается символом ma и выражается в единицах массы СИ (кг). Так, например, масса атома углерода равна: ma(С) = 19,94·10 −27 кг, а атома кислорода — ma(О) = 26,56·10 −27 кг. Масса атома самого тяжелого из существующих на Земле элементов — урана U — почти в 237 раз больше массы атома водорода.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10 −27 кг.
Относительная атомная масса
Сравнивая средние массы атомов различных элементов с атомной единицей массы, получают значения относительных атомных масс химических элементов.
Относительная атомная масса элемента — это физическая величина, которая показывает, во сколько раз масса атома данного химического элемента больше 1/12 части массы атома углерода.
Относительная атомная масса обозначается символами Ar ( А — первая буква английского слова «atomic» —атомный, r — первая буква английского слова «relative», что значит относительный), следовательно:
где Х — символ данного элемента.
Например, относительная атомная масса водорода:
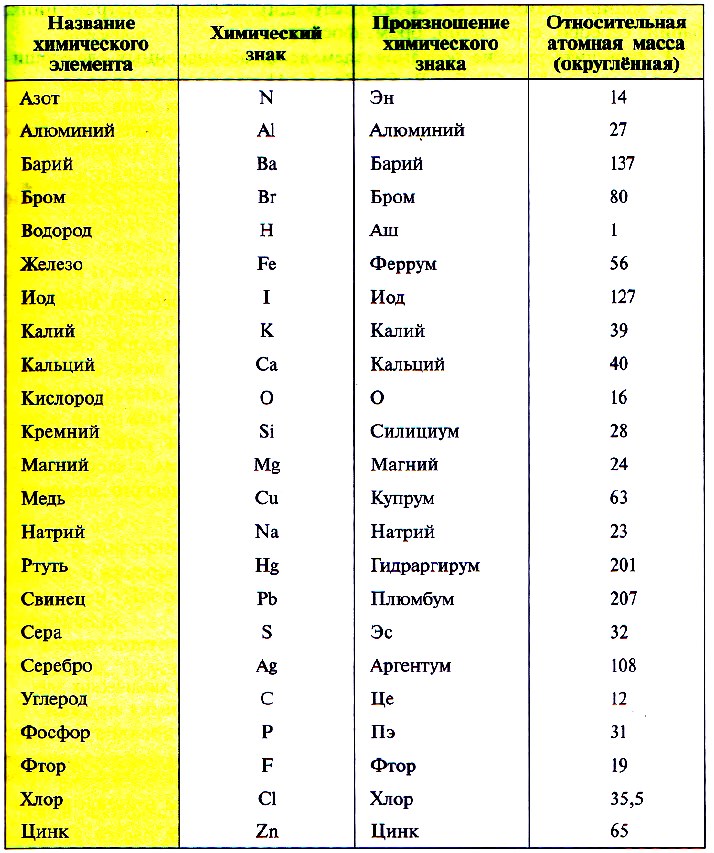
В таблице Менделеева приведены относительные атомные массы всех элементов. В расчетах при решении задач мы будем пользоваться округленными до целых значениями этих величин (см. урок 1).
Внимание! Очень часто относительную атомную массу называют просто атомной массой. Однако следует отличать атомную массу — величину относительную (например, Ar(О) = 16) — от массы атома — величины, выражаемой в единицах массы — килограммах ( ma(O) = 26,56·10 −27 кг) или атомных единицах массы ( ma(O) = 16· u ).
Пример. Во сколько раз атом ртути тяжелее атома кальция?
Решение. Относительные атомные массы элементов равны: Ar(Hg) = 201 и Ar(Ca) = 40.
Масса атома ртути равна: ma(Hg) = Ar(Hg)·u (кг).
Масса атома кальция равна: ma(Са) = Ar(Са)·u (кг).
Другими словами, отношение масс атомов этих элементов равно отношению их относительных атомных масс. Следовательно, отношение масс атомов ртути и кальция равно:
Ответ: в 5,03 раза.
Краткие выводы урока:
Надеюсь урок 2 «Относительная атомная масса химических элементов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Относительная атомная и относительная молекулярная массы
Определение и формула атомной массы
Массы атомов и молекул очень малы, поэтому в качестве единицы измерения удобно выбрать массу одного из атомов и выражать массы остальных атомов относительно нее. Именно так и поступал основоположник атомной теории Дальтон, который составил таблицу атомных масс, приняв массу атома водорода за единицу.
До 1961 года в физике за атомную единицу массы (а.е.м. сокращенно) принимали 1/16 массы атома кислорода 16 О, а в химии – 1/16 средней атомной массы природного кислорода, который является смесью трех изотопов. Химическая единица массы была на 0,03% больше, чем физическая.
В настоящее время за в физике и химии принята единая система измерения. В качестве стандартной единицы атомной массы выбрана 1/12 часть массы атома углерода 12 С.
Относительная атомная масса элемента (Ar) – это безразмерная величина, равная отношению средней массы атома элемента к 1/12 массы атома 12С.
При расчете относительной атомной массы учитывается распространенность изотопов элементов в земной коре. Например, хлор имеет два изотопа 35 Сl (75,5%) и 37 Сl (24,5%).Относительная атомная масса хлора равна:
Ar(Cl) = (0,755×m( 35 Сl) + 0,245×m( 37 Сl)) / (1/12×m( 12 С) = 35,5.
Из определения относительной атомной массы следует, что средняя абсолютная масса атома равна относительной атомной массе, умноженной на а.е.м.:
Видео
Сколько атомов в грамме вещества?
В одном грамме хлора содержится 93,03 × 10 23 молекул, опять же для удобства расчётов была введена единица измерения «моль». Моль — это 6,022 140 857(74) × 10 23 единиц. В молях можно измерять что угодно, 1 моль людей — это 6,022 140 857(74) × 10 23 людей. Данное число называется числом Авогадро, оно было рассчитано как количество атомов в 12 граммах углерода.
Поскольку а.е.м. и моль были рассчитаны исходя из массы углерода, следует запомнить следующие соотношения:
Как можно использовать данные соотношения? Если мы возьмём атомную массу любого элемента, отношение грамм/моль будет численно равно данному числу: масса серы — 32,066 а.е.м., значит один моль серы весит 32,066 грамм.
Атомная единица массы
Пользоваться такими маленькими величинами масс атомов при расчетах неудобно. К тому же, когда в XIX в. начало формироваться атомно- молекулярное учение, ученые еще не представляли реальных размеров и масс атомов. Поэтому на практике вместо истинных масс атомов стали применять их относительные значения. Они рассчитывались по массовым отношениям простых веществ в реакциях друг с другом. Химики предположили, что эти отношения пропорциональны массам соответствующих атомов. Именно так в начале XIX в. Дж. Дальтон ввел понятие относительной атомной массы, приняв за единицу сравнения массу самого легкого атома — водорода.
В настоящее время в качестве такой единицы сравнения используется 1/12 часть массы атома углерода (рис. 33). Она получила название атомной единицы массы (а. е. м.). Ее международное обозначение — u (от английского слова «unit» — единица):
Атомная единица массы — это 1/12 часть массы атома углерода, которая равна 1,66·10 −27 кг.
Нахождение атомной массы
Определить атомное число для выбранного элемента можно при помощи таблицы Менделеева. Номер элемента в таблице всегда совпадает с количеством протонов в ядре. К примеру, упомянутый выше водород имеет первый номер в таблице и в его составе содержится всего 1 протон. Ниже в таблице всегда указан средний атомный вес элемента, который для расчетов требуется округлить до ближайшего целого числа.
Таблица Менделеева изначально отображает всю информацию по количеству протонов и электронов в атоме, а также его атомной массе. Именно поэтому в школьных задачах на определение атомной массы достаточно использовать периодическую таблицу и не вычислять ничего специально.
Обычно на уроках по химии ставится обратная задача: как определить количество нейтронов в конкретном изотопе? В этом случае действует простая формула:
Количество нейтронов = атомная масса – порядковый номер.
К примеру, атом водорода-1 не содержит нейтронов, так как его атомное число равняется также единице. А вот тритий — это уже водород с одним протоном и двумя нейтронами. Тритий — нестабильный изотоп. Он легко распадается на атомы гелия, свободные электроны и антинейтрино, при этом выделяется некоторое количество энергии. Нестабильные изотопы носят название радиоактивных.
Наша программа позволяет рассчитать атомную массу конкретного изотопа, если известно его количество протонов и нейтронов. Для этого достаточно ввести в ячейки соответствующие числа и получить мгновенный результат.
Как вычислить абсолютную массу, формулы, примеры
Найти абсолютную массу молекулы C2H6. Решение Исходя из утверждения, что абсолютная масса молекулы равняется произведению ее относительной молекулярной массы на атомную единицу массы, получаем: m(C2H6)=Mr(C2H6)·1,661·10-27=49,82·10-27кг=49,82·10-24г
Найти молекулярную массу серной кислоты, используя таблицу Менделеева. Решение Известно, что молекулярная масса вещества равна сумме атомных масс веществ, входящих в состав молекулы. Поэтому: Mr(H2SO4)=1·2+32+16·4=98г/моль
Что такое атомная масса в таблице менделеева
Ключевые слова конспекта: атомная единица массы, относительная атомная масса химических элементов, относительная молекулярная масса.
Атомная единица массы — это 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Обратите внимание! На Земле встречаются три разновидности атомов углерода, различающиеся только массой. Такие разновидности атомов одного и того же элемента называют изотопами. В данном случае речь идёт о разновидности, масса атомов которой в атомных единицах массы равна 12.
Разделив массу атома какого-либо химического элемента на 1/12 массы атома углерода, получают величину, которую называют относительной атомной массой и обозначают Аr (А — от слова «атом», r — от латинского слова relativus — относительный).
Например, относительную атомную массу водорода и кислорода вычисляют следующим образом:
Относительная атомная масса элемента (Аr) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а. е. м.
Так как первую таблицу относительных атомных масс ряда элементов составил английский учёный Джон Дальтон в 1803 г, то в память о его трудах химики иногда называют атомную единицу массы дальтоном (сокращённо Da). Значение относительной атомной массы каждого химического элемента приведено в периодической таблице Д. И. Менделеева. На практике эти значения обычно округляют до целых чисел.
Относительная молекулярная масса
Массу молекул, так же как массу атомов, принято выражать в атомных единицах массы. Разделив массу молекулы какого-либо вещества на 1/12 массы атома углерода, получают величину, которую называют относительной молекулярной массой вещества.
Относительная молекулярная масса вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода, масса которого равна 12 а.е.м.
Относительная молекулярная масса Мr — безразмерная величина. Она складывается из относительных атомных масс элементов, составляющих молекулу, например:
Конец конспекта «Относительная атомная масса. Относительная молекулярная масса».
Молекулярная физика. Атомная единица массы. Атомная масса.
Атомная единица массы.
Атомная единица массы (а.е.м.) — единица массы, равная 1/12 массы атома изотопа углерода 12 С:
Чтобы перевести значение массы атомов или молекул, выраженной в а.е.м., т. е. относительную молекулярную (или атомную) массу вещества Mr, в единицу массы СИ (кг), пользуются формулой:

Относительная молекулярная масса (атомная масса) — относительное значение массы молекулы (атома), выраженное в атомных единицах массы:

где Mr — относительная молекулярная (атомная) масса; m0 — масса молекулы (атома), выраженная в единицах СИ (кг); m0С — масса молекулы изотопа углерода 12 С, выраженная в тех же единицах, что и m0.

Атомная масса была взята Д. И. Менделеевым за основную характеристику элемента при открытии им периодической системы элементов. Атомная масса — дробная величина, в отличие от массового числа — количества нуклонов в атоме.
Относительная молекулярная масса вещества складывается из относительных атомных масс (а.м.) входящих в молекулу элементов.
Атомные массы всех химических элементов точно измерены.
Атомная масса
А́томная ма́сса, относительная атомная масса (устаревшее название — атомный вес) — значение массы атома, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопа углерода 12 C, поэтому атомная масса этого изотопа по определению равна точно 12. Разность между атомной массой изотопа и его массовым числом называется избытком массы (обычно его выражают в МэВ). Он может быть как положительным, так и отрицательным; причина его возникновения — нелинейная зависимость энергии связи ядер от числа протонов и нейтронов, а также различие в массах протона и нейтрона.
Зависимость атомной массы изотопа от массового числа такова: избыток массы положителен у водорода-1, с ростом массового числа он уменьшается и становится отрицательным, пока не достигается минимум у железа-56, потом начинает расти и возрастает до положительных значений у тяжёлых нуклидов. Это соответствует тому, что деление ядер, более тяжёлых, чем железо, высвобождает энергию, тогда как деление лёгких ядер требует энергии. Напротив, слияние ядер легче железа высвобождает энергию, слияние же элементов тяжелее железа требует дополнительной энергии.
Атомная масса химического элемента (также «средняя атомная масса», «стандартная атомная масса») является средневзвешенной атомной массой всех стабильных изотопов данного химического элемента с учётом их природной распространённости в земной коре и атмосфере. Именно эта атомная масса представлена в периодической таблице Д. И. Менделеева, её используют в стехиометрических расчётах. Атомная масса элемента с нарушенным изотопным соотношением (например, обогащённого каким-либо изотопом) отличается от стандартной. Для моноизотопных элементов (таких как иод, золото и т. п.) атомная масса элемента совпадает с атомной массой его единственного представленного в природной смеси изотопа.
Молекулярной массой химического соединения называется сумма атомных масс элементов, составляющих её, умноженных на стехиометрические коэффициенты элементов по химической формуле соединения. Строго говоря, масса молекулы меньше массы составляющих её атомов на величину, равную энергии связи молекулы. Однако этот дефект массы на 9-10 порядков меньше массы молекулы, и им можно пренебречь.
Определение моля (и числа Авогадро) выбирается таким образом, чтобы масса одного моля вещества (молярная масса), выраженная в граммах, была численно равна атомной (или молекулярной) массе этого вещества. Например, атомная масса железа равна 55,847. Следовательно один моль железа (т. е. количество атомов железа, равное числу Авогадро, 6,022·10 23 ) имеет массу 55,847 г.
Прямое сравнение и измерение масс атомов и молекул выполняется с помощью масс-спектрометрических методов.
История
До 1960-х годов атомную массу определяли таким образом, чтобы нуклид кислород-16 имел атомную массу 16 (кислородная шкала). Однако соотношение кислорода-17 и кислорода-18 в природном кислороде, который также использовался в расчётах атомной массы, приводило к наличию двух разных таблиц атомных масс. Химики использовали шкалу, основанную на том, что естественная смесь изотопов кислорода должна была иметь атомную массу 16, тогда как физики присваивали то же число 16 атомной массе наиболее распространённого изотопа кислорода (имеющего восемь протонов и восемь нейтронов).