что такое атомная доля
§ 1.4. Молекулы. Формулы веществ. Относительная молекулярная масса. Массовая доля элемента в соединении
На данный момент известно около 120 разных химических элементов, из которых в природе можно обнаружить не более 90. Многообразие же различных химических веществ вокруг нас несоизмеримо больше этого числа.
Связано это с тем, что крайне редко химические вещества состоят из отдельных, не связанных между собой атомов химических элементов. Таким строением в обычных условиях обладает лишь небольшой ряд газов называемых благородными — гелий, неон, аргон, криптон, ксенон и радон. Чаще же всего, химические вещества состоят не из разрозненных атомов, а из их объединений в различные группировки.
То есть атомы большинства химических элементов способны связываться друг с другом. Чаще всего в результате этого получаются молекулы – частицы, представляющие собой группировки из двух или более атомов. Например, химическое вещество водород состоит из молекул водорода, которые образуются из атомов следующим образом:
Рисунок 3. Образование молекулы водорода
Образовывать связи друг с другом могут и атомы разных химических элементов, так, например, при взаимодействии атома кислорода с двумя атомами водорода образуется молекула воды:
Рисунок 4. Образование молекулы воды
Поскольку каждый раз рисовать атомы химических элементов и подписывать их неудобно, для отражения состава молекул были придуманы химические формулы. Так, например, формула молекулярного водорода записывается как Н2, где число 2, написанное подстрочным шрифтом справа от символа атома водорода, означает количество атомов данного типа в молекуле. Таким образом, формулу воды можно записать как H2O. Единица, которая должна показывать количество атомов кислорода в молекуле, согласно принятым в химии правилам, не пишется. Числа, обозначающие количества атомов в составе одной молекулы называют индексами.
Рассмотрим еще несколько примеров химических формул веществ. Так, формула аммиака записывается как NH3, что говорит о том, что каждая молекула аммиака состоит из одного атома азота и трех атомов водорода.
Нередко встречаются молекулы, в которых можно насчитать несколько одинаковых групп атомов. Например, из формулы сульфата алюминия Al2(SO4)3, можно сделать вывод о том, что в составе молекулы данного вещества находятся две группы атомов SO4.
Таким образом, химические формулы веществ однозначно характеризуют как их качественный, так и количественный состав.
Из всего вышесказанного логично вытекает закон постоянства состава вещества, установленный еще в 1808 году французским ученым Жозефом Луи Прустом, и звучит он следующим образом:
Любое чистое химическое вещество имеет постоянный качественный и количественный состав, не зависящий от способа получения этого вещества.
Поскольку любое химическое вещество является совокупностью молекул одинакового состава, это приводит к тому, что пропорции между атомами химических элементов в любой порции вещества такие же, как и в одной молекуле данного вещества. Все различия в химических свойствах веществ зависят от количественного и качественного состава молекул и кроме того, от порядка связей атомов между собой, если таковое возможно.
Таким образом, можно дать следующее определение термина молекула:
Молекула – это наименьшая частица какого-либо химического вещества обладающая его химическими свойствами.
Аналогично относительной атомной массе, существует также и такое понятие как относительная молекулярная масса Mr:
Относительная молекулярная масса (Mr) вещества это отношение массы одной молекулы этого вещества к одной двенадцатой массы одного атома углерода (1 атомной единице массы).
Таким образом, очевидно, что относительная молекулярная масса складывается из относительных атомных масс элементов, каждая из которых помножена на количество атомов данного конкретного типа в одной молекуле. Так, например, относительная молекулярная масса молекулы азотной кислоты HNO3 складывается из относительной атомной массы водорода, относительной атомной массы азота и трех относительных атомных масс кислорода:
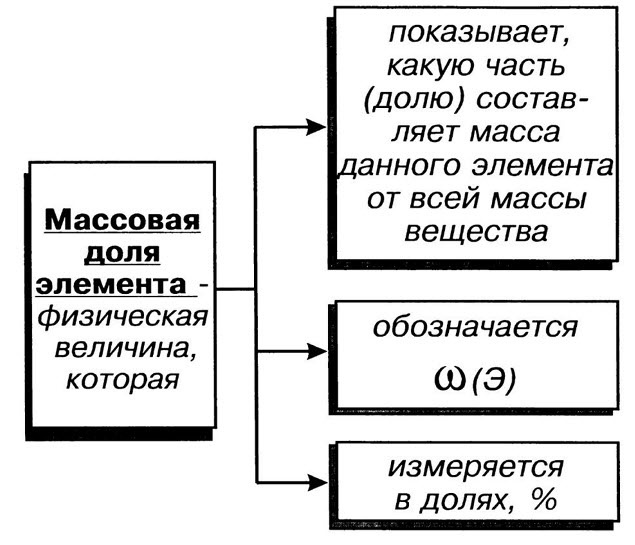
Для описания качественного и количественного состава вещества используют такое понятие как массовая доля химического элемента w(X):
Массовая доля (ω) химического элемента в веществе — это отношение относительной атомной массы Ar(X) данного элемента, помноженной на число его атомов в молекуле, к относительной молекулярной массе Ar(X) данного вещества.
где ω(Х) — массовая доля элемента X; Аr(Х) — его относительная атомная масса; n — число атомов X в одной молекуле вещества; Мr — относительная молекулярная масса химического вещества.
Чаще всего, массовую долю химического элемента выражают в процентах, в этом случае формульное выражение массовой доли в процентах ω%(Х) будет иметь вид:
Рассчитаем в качестве примера массовые доли водорода, азота и кислорода в молекуле азотной кислоты (НNO3):
Урок №13. Массовая доля химического элемента в соединении
Массовая для элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
w – массовая доля элемента в веществе,
n – индекс в химической формуле,
Ar – относительная атомная масса,
Mr – относительная молекулярная масса молекулы вещества.
Массовые доли выражают в процентах или в долях:
w (элемента) = 20% или 0,2.
Вычислите массовые доли элементов в фосфорной кислоте, имеющей простейшую химическую формулу H 3 PO 4 , с точностью до сотых.
Дано :
Найти :
Решение :
1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав фосфорной кислоты
2. Вычисляем относительную молекулярную массу соединения
Mr(H 3 PO 4 ) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98
3. Вычисляем массовые доли элементов по формуле:
w (элемента) = (n· Ar(элемента) · 100%) / Mr( молекулы )
w(H) = n(H)·Ar(H)·100% / Mr(H 3 PO 4 ) = 3·1·100% / 98 = 3,06%
w(P) = n(P)·Ar(P)·100% / Mr(H 3 PO 4 ) = 1·31·100% / 98 = 31,63%
w(O) = n(O)·Ar(O)·100% / Mr(H 3 PO 4 ) = 4·16·100% / 98 = 65,31%
Сумма значений массовых долей всех элементов должна составить 100% w(H) + w(P) + w(O) = 100%
3,06% + 31,63% + 65,31% = 100%
Таким образом, массовые доли элементов в фосфорной кислоте вычислены правильно.
Атомная доля стабильного изотопа
2. Атомная доля стабильного изотопа
Отношение числа атомов данного стабильного изотопа к общему числу атомов этого элемента
Смотреть что такое «Атомная доля стабильного изотопа» в других словарях:
ГОСТ 26335-84: Соединения и изделия со стабильными изотопами. Марки — Терминология ГОСТ 26335 84: Соединения и изделия со стабильными изотопами. Марки оригинал документа: 2. Атомная доля стабильного изотопа Отношение числа атомов данного стабильного изотопа к общему числу атомов этого элемента Определения термина… … Словарь-справочник терминов нормативно-технической документации
Атом — У этого термина существуют и другие значения, см. Атом (значения). Атом гелия Атом (от др. греч … Википедия
Драгоценные металлы — (Precious metals) Драгоценные металлы это редко встречающиеся металлы, которые отличаются блеском, красотой и стойкостью к коррозии История добычи драгоценных металлов, разновидности, свойства, применение, распространение в природе, сплавы… … Энциклопедия инвестора
Άτομο — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Корпускул — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Корпускулы — Атом гелия Атом (др. греч. ἄτομος неделимый) наименьшая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и окружающего его электронного облака. Ядро атома состоит из положительно заряженных протонов и… … Википедия
Золото — У этого термина существуют и другие значения, см. Золото (значения). 79 Платина ← Золото → Ртуть … Википедия
Лантан — У этого термина существуют и другие значения, см. Лантан (значения). 57 Барий ← Лантан → Церий … Википедия
Что такое атомная доля
Ключевые слова конспекта: массовая доля элемента в соединении, вычисления по химическим формулам.
Относительная атомная масса элемента ( Аr ) показывает, во сколько раз масса его атома больше 1/12 массы атома углерода, масса которого равна 12 а.е.м. Относительная молекулярная масса ( Мr ) вещества показывает, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода. Она складывается из относительных атомных масс элементов, составляющих молекулу:
Массовая доля химического элемента ( ω ) в сложном веществе показывает, какая доля от всей массы сложного вещества приходится на массу этого элемента.
Массовая доля элемента в соединении равна отношению его массы в данном веществе к относительной молекулярной массе этого вещества
Вывод химических формул,
если известны массовые доли химических элементов,
входящих в состав данного вещества
Задача. Известно, что массовые доли натрия, серы и кислорода в данном веществе соответственно составляют 29,1 %, 40,51 % и 30,38 %. Вычислите индексы в химической формуле вещества NaxSyOz
Решение. Прежде всего из условия задачи следует, что в 100 единицах массы вещества: 29,1 единицы натрия, 40,51 единицы серы и 30,38 единицы кислорода. Если каждое из этих чисел разделить на относительные атомные массы соответствующих элементов; то в таком случае находим число атомов каждого элемента в 100 единицах вещества:
29,1 : 23 = 1,265 атома Na
40,51 : 32 = 1,266 атома S
30,38 : 16 = 1,899 атома О
В результате можно определить соотношение чисел атомов в формуле вещества:
х : у : z = 1,265 : 1,266 : 1,899
Чтобы получить соотношения целых чисел; разделим все числа атомов на наименьшее из них (на 1,265):
1 : 1 : 1,5
Для того чтобы количество атомов кислорода было выражено целым числом; полученные числа атомов умножаем на два:
х : у : z = (1 • 2) : (1 • 2) : (1,5 • 2) = 2 : 2 : 3
Эти числа принимаются в качестве индексов в простейшей формуле данного вещества — Na2S203.
Конспект урока «Массовая доля элемента в соединении».
Что такое атомная доля
Репетитор по химии и биологии
100 баллов ЕГЭ по химии!
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
РГМУ по химии 2010
РНИМУ им. Н.И. Пирогова
выпускница репетитора В.Богуновой
Первый МГМУ им. И.М. Сеченова
выпускница репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускник репетитора В.Богуновой
МГМСУ, лечебный факультет
выпускница репетитора В. Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
РНИМУ им. Н.И. Пирогова
выпускник репетитора В.Богуновой
Секретная шпаргалка по химии.
3.1 Массовая доля элемента в соединении
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Например, мы купили у бабули на рынке ведро яблок и груш общей массой 10 кг. Дома разделили фрукты на две кучки. Масса груш составила 3 кг. Значит, массовая доля груш 3/10 = 0,3 (30%). Вспомнили, как рассчитать массовую долю? Отлично! Поехали дальше.
Определите массовую долю железа в оксиде железа (III)
Записываем формулу массовой доли в общем виде, затем конкретизируем ее. Читаем внимательно и следим за моими руками. Массовая доля элемента в соединении определяется отношением массы атомов (числитель) к массе молекулы (знаменатель), то есть:
1) в числителе мы работаем с атомами того элемента, чью массовую долю определяем, для этого умножаем атомную массу элемента (молярная масса атомов) на число атомов этого элемента
2) в знаменателе мы записываем молярную массу вещества
Соединение элемента имеет формулу Э2О3, массовая доля элемента в нем 68,42%. Установите элемент.
Для определения неизвестного элемента необходимо рассчитать его атомную массу (молярную массу атомов), а затем по Периодической системе химических элементов Д.И. Менделеева по атомной массе определяем химический элемент.
Оксид неизвестного пятивалентного элемента содержит 56,34% кислорода. Определите этот элемент.
Массовая доля водорода в алкине CnH2n-2 составляет 12,2%. Определите число атомов углерода
Массовая доля водорода в молекуле алкина CnH2n-2 равна 11,11 %. Определите число атомов углерода
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами.






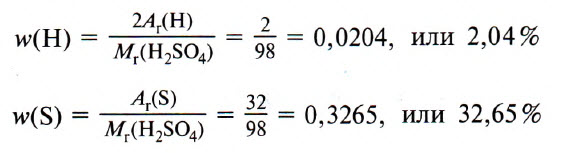






m.jpg)
m.jpg)
m.jpg)

m.jpg)
m.jpg)
_m.jpg)
_0.jpg)
_1.jpg)
_2.jpg)
_3.jpg)
_4.jpg)
_5.jpg)