что такое афс в фармацевтике
Фармацевтическая продукция. Лекарственные средства. Фармацевтические субстанции
В соответствии с Федеральным Законом N 61-ФЗ «Об обращении лекарственных средств», а так же в соответствии с ГОСТ Р 52249-2009. «Правила производства и контроля качества лекарственных средств»:
Фармацевтические субстанции (они же «Активные фармацевтические субстанции» или сокращенно «АФС») — лекарственные средства в виде действующих веществ биологического, биотехнологического, минерального или химического происхождения, обладающие фармакологической активностью, предназначенные для производства, изготовления лекарственных препаратов и определяющие их эффективность. [В соответствии с Федеральным Законом N 61-ФЗ «Об обращении лекарственных средств»]
Активные фармацевтические субстанции; АФС (active pharmaceutical ingredient; API): Любое вещество или смесь веществ, предназначенные для производства лекарственных средств, которые в процессе производства лекарственного средства становятся активным ингредиентом этого лекарственного средства. Такие вещества предназначены для проявления фармакологической активности или другого прямого эффекта при диагностике, лечении, облегчении симптомов или профилактике болезни или для воздействия на структуру или функцию организма. [В соответствии с ГОСТ Р 52249-2009. «Правила производства и контроля качества лекарственных средств»]
Термины «Активная фармацевтическая субстанция» (рус.: «АФС», анг.: «Active Pharmaceutical Ingredient» или «API»), «Активная субстанция», «Лекарственная субстанция» (drug substance) — являются синонимами.
Наши покупатели это не потребители лекарств, а предприятия, выпускающие конечную продукцию — готовые лекарственные средства (ГЛС). Конечно, фармацевтические субстанции, являющиеся сырьём для фармацевтической промышленности выпускают не только в России. Один из крупнейших поставщиков лекарственных субстанций – Китай. Стоимость фармацевтических субстанций китайского происхождения порою дешевле, но качество оставляет желать лучшего. Нашими потребителями являются как крупные Российские фармацевтические компании, так и некоторые зарубежные фармацевтические компании. Круг наших заказчиков достаточно широк. Для них очень важен имидж своего товарного знака, поэтому они используют качественное сырье, закупаемое у нашего предприятия. Мы уверены, что лекарства Российского производства не только качественные, могут конкурировать с импортными, но и лучшие!
Постоянная ссылка на это сообщение: http://sktb-technolog.ru/pharma/
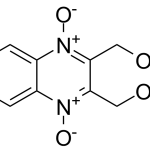
Гидроксиметилхиноксалиндиоксид (Hydroxymethylquinoxalindioxyde, Диоксидин®) CAS: 17311-31-8
Фармацевтическая субстанция «Гидроксиметилхиноксалиндиоксид» Наименование фармацевтической субстанции: Гидроксиметилхиноксалиндиоксид Международное непатентованное наименование (МНН): Гидроксиметилхиноксалиндиоксид / Hydroxymethylquinoxalindioxyde Химическое наименование: 2,3-Бис-(гидроксиметил)хиноксалина 1,4-ди-N-оксид Производитель: ФГУП «СКТБ «Технолог» CAS №: 17311-31-8 Номер реестровой записи в Государственном реестре лекарственных средств: ЛСР-002744/09 Дата включения в реестр: 07.04.2009 Эмпирическая формула: C10H10N2O4 Фармакологические свойства: Противомикробное средство Cубстанция-порошок, предназначена для производства лекарственных препаратов: в виде растворов, …
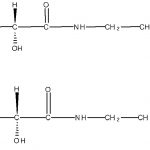
Кальциевая соль гопантеновой кислоты (CAS: 1990-07-4).
Фармацевтическая субстанция « Кальциевая соль гопантеновой кислоты » Наименование фармацевтической субстанции: Кальциевая соль гопантеновой кислоты Международное непатентованное наименование (МНН): Гопантеновая кислота (Hopantenic acid) Синонимы: Пантогам, Кальция гопантенат, calcium hopantenate hemihydrate Химическое наименование: (R)-4-[(2,4-дигидрокси-3,3-диметилбутирил)амино]-бутират кальция (2:1) Производитель: ФГУП «СКТБ «Технолог» CAS №: 1990-07-4 Номер реестровой записи в Государственном реестре лекарственных средств: Р N003448/01 Дата включения в …
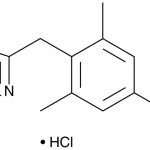
Ксилометазолин / Xylometazoline (CAS: 1218-35-5).
Фармацевтическая субстанция «Ксилометазолина гидрохлорид» (Ксилометазолин) Наименование фармацевтической субстанции: Ксилометазолина гидрохлорид Международное непатентованное наименование (МНН): Ксилометазолин / Xylometazoline Химическое наименование: 2-[[4-(1,1-диметилэтил)-2,6-диметилфенил] метил]-4,5-дигидро-1Н-имидазолагидрохлорид Производитель: ФГУП «СКТБ «Технолог» CAS №: 1218-35-5 Номер реестровой записи в Государственном реестре лекарственных средств: ФС-001730 Дата включения в реестр: 11.01.2018 Эмпирическая формула: C16H24N2 • HCl Фармакологические свойства: сосудосуживающее, антиконгестивное средство Cубстанция-порошок, предназначена для …
Пазопаниб / Pazopanib (CAS: 444731-52-6)
Фармацевтическая субстанция Пазопаниб Наименование фармацевтической субстанции: Пазопаниб Международное непатентованное наименование (МНН): Пазопаниб Химическое наименование: 5-[[4-[(2,3-Диметил-2H-индазол-6-ил)метиламино]-2-пиримидинил]амино]-2-метилбензосульфонамид Производитель: ФГУП «СКТБ «Технолог» CAS №: 444731-52-6 Номер реестровой записи в Государственном реестре лекарственных средств: ФС-001946 Дата включения в реестр: 18.09.2019 Эмпирическая формула: C21H23N7O2S Фармакологические свойства: Противоопухолевое средство — ингибитор протеинкиназ Cубстанция-порошок, предназначена для производства лекарственных препаратов в форме таблеток. …
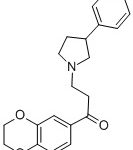
ПРОРОКСАН / PROROXAN HCL (CAS: 33025-33-1).
Фармацевтическая субстанция «Пророксан» Наименование фармацевтической субстанции: Пророксан, субстанция-порошок Международное непатентованное наименование (МНН): Пророксан Химическое наименование: 6-[3-(3-фенил-пирролидинил-1)-пропионил]-бензодиоксана-1,4 гидрохлорид. CAS №: 33025-33-1 Номер реестровой записи в Государственном реестре лекарственных средств: ФС 001430-090616 Дата включения в реестр: 09.06.2016 Эмпирическая формула: C21H23NO3 · HCl. Фармакологические свойства: альфа-адреноблокатор Лекарственное средство Пророксан, субстанция-порошок, предназначено для производства лекарственных препаратов в форме таблеток. …
Список выпускаемых фарм. субстанций, лекарственных средств
Одним из направлений деятельности ФГУП СКТБ «Технолог» является разработка и изготовление фармацевтической продукции. Мы производим лекарственные средства. Если быть более точными, то ФГУП СКТБ «Технолог» производит фармацевтические субстанции, которые используются для производства ГЛП (Готовые Лекарственные Препараты) и ГЛС (Готовые Лекарственные Средства). СКТБ «Технолог» является одним из ведущих производителей синтетических фармацевтических субстанций в России. По некоторым …
Тримекаин / Trimecainum (CAS: 616-68-2)
Фармацевтическая субстанция «Тримекаин» Тримекаин ( систематическое название (2,4,6-триметилфенилкарбамоилметил) диэтиламмоний хлорид, химическая формула C15H25ClN2O) представляет собой органическое соединение, используемое в качестве местного анестетика и кардиального антиаритмического средства. Это белый кристаллический порошок, легко растворимый в воде и этаноле Наименование фармацевтической субстанции: Тримекаин Международное непатентованное наименование (МНН): Тримекаин Форма выпуска субстанции: Субстанция-порошок Химическое наименование: 2-(Диэтиламино)-N-(2,4,6-триметилфенил)ацетамид (в виде гидрохлорида) …
Перспективные фарм. субстанции, готовые к производству
Уважаемые дамы и господа, обращаем ваше внимание на то, что наше предприятие, ФГУП «СКТБ «Технолог», является единственным предприятием на северо-западе России, которое специализируется на сложном многостадийном синтезе и самостоятельно производит фарм. субстанции, получаемые в результате ПОЛНОГО ЦИКЛА такого синтеза. Наше предприятие ведет свою деятельность начиная с 1963 года и за эти годы нами накоплен огромный опыт. …
Метацин (Метоциния йодид)
Фарм. субстанция «Метацин» имеет второе, международное непатентованное (химическое) наименование: «Метоциния йодид» Если Вы ищите фармацевтическую субстанцию « метацин », то Вы зашли на правильный сайт, ФГУП «СКТБ «Технолог» имеет большой опыт выпуска различных химических соединений и высококачественных фармацевтических субстанций, в числе которых есть и «Метацин». Впервые мы начали производить данную фарм. субстанцию в июле 1967 года и именно тогда она была …
Нафтизин (Нафазолин) / Naphazoline. CAS: 5144-52-5
Фармацевтическая субстанция Нафтизин Наименование фармацевтической субстанции: Нафтизин Международное непатентованное наименование (МНН): Нафазолин Химическое наименование: 2-(1-нафтилметил)-2-имидазолина нитрат Производитель: ФГУП «СКТБ «Технолог» CAS №: 5144-52-5 Номер реестровой записи в Государственном реестре лекарственных средств: ЛСР-008982/10 Дата включения в реестр: 31.08.2010 Эмпирическая формула: C14H14N2 · НNO3 Фармакологические свойства: альфа-адреномиметическое, антиконгестант Белый или почти белый кристаллический порошок. Умеренно растворим в …
Повиаргол
Повиаргол (Poviargolum) — Серебросодержащий бактерицидный препарат нового поколения. Производитель: ФГУП «СКТБ «ТЕХНОЛОГ», РОССИЯ, 193 177 г. Санкт-Петербург, Советский пр. 33а Высокоэффективное антимикробное средство с широким спектром действия, ак-тивное в отношении аэробной и анаэробной грамположительной и грамнегативной микрофлоры, в том числе антибиотикорезистентной. Обладает противовоспалительным действием и стимулирует репарацию тканей на стадии эпителизации. Стимулирует клеточный и гуморальный …
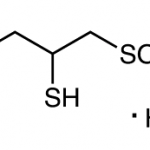
Унитиол / Unithiol (CAS: 207233-91-8)
Фармацевтическая субстанция Унитиол Наименование фармацевтической субстанции: Унитиол Международное непатентованное наименование (МНН): Димеркаптопропансульфонат натрия Химическое наименование: 2,3-димеркаптопропансульфонат натрия моногидрат Производитель: ФГУП «СКТБ «Технолог» CAS №: 207233-91-8 Номер реестровой записи в Государственном реестре лекарственных средств: Р N003207/01 Дата включения в реестр: 13.05.2009 Эмпирическая формула: С3Н7NaO3S3 · H2O Фармакологические свойства: дезинтоксикационное лекарственное средство Унитиол (Димеркапрол, Димеркаптопропансульфонат натрия) Срок …
Добавить комментарий Отменить ответ
Для отправки комментария вам необходимо авторизоваться.
Часть II. Основные требования к активным фармацевтическим субстанциям (АФС), используемым в качестве исходных материалов
Часть II
Основные требования к активным фармацевтическим субстанциям (АФС), используемым в качестве исходных материалов
Данная часть стандарта является руководством по применению правил GMP к производству активных фармацевтических субстанций (АФС) с целью обеспечения гарантии их качества и соответствия требованиям к чистоте.
Термин «производство» включает в себя все виды операций с АФС: приемку исходного сырья, производство, упаковку, переупаковку, маркировку, перемаркировку, контроль качества, выпуск продукции, хранение и реализацию, а также соответствующие меры контроля. Понятия «должен», «следует», применяемые в настоящем руководстве, указывают на рекомендации, выполнение которых предполагается, за исключением случаев, когда их выполнить невозможно или они могут быть заменены альтернативными действиями, по крайней мере, с эквивалентным уровнем обеспечения качества продукции.
Стандарт не затрагивает вопросов безопасности персонала, занятого в производстве, и требований по защите окружающей среды. Производитель несет ответственность за безопасность персонала и окружающей среды в соответствии с законодательством.
Стандарт не устанавливает требований, предъявляемых при регистрации (подаче заявки на регистрацию) АФС, и не заменяет требований Фармакопеи, не затрагивает полномочий соответствующих органов по установлению специфических требований к АФС для выдачи разрешения на реализацию/производство или применение лекарственных средств. Следует выполнять все требования, установленные при государственной регистрации АФС.
1.2 Область применения
Стандарт устанавливает требования к производству АФС, используемых в лекарственных средствах для человека и животных (медицинских препаратах). К производству стерильных АФС оно применимо только до стадии стерилизации. Стандарт не распространяется на процессы стерилизации и производство стерильных АФС в асептических условиях. Эти процессы следует проводить в соответствии с требованиями настоящего стандарта (в т.ч. приведенными в приложении 1) и других нормативных документов.
В случае производства средств против эктопаразитов могут использоваться другие нормативные документы.
Раздел 19 стандарта содержит требования, распространяющиеся только на производство АФС, используемых для получения лекарственных средств, предназначенных для клинических исследований (исследовательских лекарственных средств).
Производитель АФС должен определить и документально оформить стадию, с которой должно начинаться производство АФС из исходного сырья. Для процессов химического синтеза эта стадия определяется как стадия ввода исходных материалов в технологический процесс производства АФС. Для других процессов (ферментации, экстракции, очистки и пр.) данную стадию определяют с учетом конкретных особенностей производства. В таблице 1 приведены стадии производства различных АФС с выделением стадий, на которых исходный материал, как правило, вводится в технологический процесс.
Начиная с этой стадии, на данные промежуточные продукты и/или стадии производства АФС действуют правила данной части стандарта. Они включают в себя требования к аттестации (испытаниям) критических стадий технологического процесса, оказывающих влияние на качество АФС. В то же время выбор стадий технологического процесса для проведения аттестации (испытаний) не обязательно означает, что эти стадии являются критическими для качества АФС.
Требования настоящей части распространяются, как правило, на стадии, выделенные в таблице 1 серым фоном. Это не означает, что в процессе производства должны выполняться все стадии, указанные в данной таблице. Строгость следования требованиям GMP должна возрастать от ранних стадий производства АФС к завершающим стадиям технологического процесса, очистки и упаковки. Физическую обработку АФС, такую как грануляция, покрытие оболочкой или физическое изменение размера частиц (например, грубый и тонкий помол), следует проводить, по крайней мере, в соответствии с требованиями настоящего стандарта.
Стадии производства АФС, на которые распространяется данный стандарт (выделены серым фоном)
Что такое афс в фармацевтике
11. Лабораторный контроль
11.1. Общий контроль
11.10. Служба контроля качества должна иметь в своем распоряжении необходимые лабораторные помещения и оборудование.
11.11. Следует разработать и документально оформить методики отбора проб, проведения испытаний, выдачи разрешения на использование или отклонение материалов, регистрации и хранения данных, полученных в лаборатории. Ведение протоколов и отчетов должно соответствовать требованиям 6.6.
11.12. Все спецификации, планы отбора проб и методики проведения испытаний должны быть научно обоснованными и гарантировать, что сырье, АФС и промежуточные продукты, а также печатные и упаковочные материалы соответствуют установленным стандартам качества и/или чистоты. Спецификации и методики испытаний должны соответствовать требованиям, установленным при государственной регистрации. Допускается использовать спецификации, не входящие в регистрационное досье. Спецификации, планы отбора проб и методики испытаний, в т.ч. изменения к ним, должны быть разработаны соответствующим подразделением, рассмотрены и согласованы со службой (отделом) контроля качества.
11.13. Спецификации для АФС должны быть разработаны в соответствии с действующими нормами и технологическим процессом и включать в себя контроль за примесями (например, органическими и неорганическими примесями и остаточным содержанием растворителей). Если для АФС предусмотрены требования к микробиологической чистоте, то в спецификации должны быть установлены допустимые пределы для общего числа микроорганизмов и нежелательных микроорганизмов. Если для АФС предусмотрены требования к апирогенности, то в спецификации должны быть установлены допустимые пределы к уровню эндотоксинов.
11.14. Все операции контроля в лабораториях должны проводиться в соответствии с утвержденными методиками (инструкциями) и оформляться в письменном виде непосредственно после их проведения. Любые отклонения от указанных методик должны быть обоснованы.
11.15. Любые результаты, выходящие за рамки спецификаций, должны быть расследованы и оформлены в соответствии с принятой методикой, предусматривающей проведение анализа данных, оценку существенной проблемы, определение путей решения этой проблемы и формулирование выводов из проведенного расследования. После получения результатов, выходящих за рамки спецификаций, повторные отборы проб и/или повторные испытания должны проводиться в соответствии с принятыми методиками.
11.16. Реактивы и стандартные растворы должны приготавливаться и маркироваться в соответствии с принятой методикой. Для аналитических реактивов и растворов следует применять маркировку «Использовать до».
11.17. Для производства АФС необходимо иметь первичные стандартные образцы и документацию о происхождении каждого стандартного образца. Данные о хранении и использовании каждого первичного стандартного образца согласно рекомендациям поставщика должны быть приведены в соответствующих протоколах. Первичные стандартные образцы, полученные из официально признанных источников и хранящиеся в соответствии с рекомендациями поставщика, используют без проведения испытаний.
11.18. При невозможности получения первичных стандартных образцов из официально признанных источников следует разработать внутренние стандартные образцы производителя. Для установления подлинности и чистоты первичного стандартного образца требуется проведение соответствующего контроля. Проведение контроля должно быть оформлено документально.
11.19. Следует разработать порядок изготовления, установления, идентификации, испытаний, утверждения и хранения вторичных стандартных образцов. Пригодность каждой серии вторичного стандартного образца должна быть определена до момента первого использования путем его сравнения с первичным стандартным образцом. Каждая серия вторичного стандартного образца должна периодически проходить проверку (аттестацию) в соответствии с утвержденной методикой.
11.2. Проведение испытаний промежуточных продуктов и АФС
11.20. Для подтверждения соответствия каждой серии промежуточного продукта и АФС требованиям спецификаций должны быть проведены необходимые лабораторные испытания.
11.21. Для каждой АФС должен быть определен состав примесей (идентифицированных и неидентифицированных), присутствующих в обычной серии, произведенной в ходе конкретного контролируемого технологического процесса. Описание примесей должно включать в себя их идентификацию или какие-либо качественные аналитические параметры, позволяющие ее идентифицировать (например, время удерживания), диапазон содержания каждой выявленной примеси и их классификацию (неорганическая, органическая, растворитель). Состав примесей обычно зависит от технологического процесса и природы АФС. Для АФС, получаемых из растительного сырья или из тканей животных, определение состава примесей обычно не требуется. Требования к АФС, получаемым биотехнологическим путем, должны быть установлены в соответствующей нормативной документации.
11.22. Для выявления изменений в АФС, происходящих вследствие изменений в сырье, оборудовании, рабочих параметрах или технологическом процессе, состав примесей периодически следует сравнивать с составом примесей, указанных в документации, оформляемой при государственной регистрации, или с данными, полученными ранее.
11.23. Следует проводить контроль микробной чистоты каждой серии промежуточного продукта и АФС в соответствии с установленными требованиями.
11.3. Аттестация аналитических методик (см. раздел 12)
11.4. Аналитические паспорта
11.42. В аналитическом паспорте должны быть перечислены все испытания, проведенные в соответствии с нормативными документами или требованиями заказчика, в т.ч. критерии приемлемости и полученные количественные результаты (при их наличии).
11.44. Новые аналитические паспорта, выпускаемые вторичным предприятием-упаковщиком или производителем, поставщиками или лицами, действующими от их имени, должны содержать наименование, адрес и телефон лаборатории, проводившей эти анализы. В них также должны быть указаны наименование, адрес первичного производителя и оригинал паспорта на эту серию продукции с приложением его копии.
11.5. Контроль стабильности АФС
11.50. Следует разработать и документально оформить программу непрерывного контроля стабильности АФС, результаты которого должны использоваться для подтверждения условий хранения при пересмотре срока годности или срока проведения повторного контроля.
11.51. Методики испытаний на стабильность должны быть аттестованы.
11.52. Пробы для контроля стабильности следует хранить в упаковках, имитирующих коммерческие упаковки. Например, для АФС, поставляемых в мешках, помещенных в картонные барабаны, пробы для контроля стабильности могут быть упакованы в мешки из того же материала, помещенные в барабаны, меньшие по размеру и изготовленные из похожего или такого же материала, как и для АФС, поступающих в реализацию.
11.53. Для подтверждения даты проведения повторного контроля или срока годности АФС первые три реализуемые серии, как правило, должны быть испытаны на стабильность. Если результаты предыдущих испытаний показывают, что данная серия АФС будет сохранять стабильность еще не менее двух лет, допускается использовать менее трех серий.
11.54. В программу контроля стабильности ежегодно должна включаться, по крайней мере, хотя бы одна серия производимой АФС (за исключением случаев, когда в этот год ее производство не осуществлялось).
11.55. Для АФС с коротким сроком годности испытания следует проводить чаще. Например, для биотехнологических/биологических и других АФС со сроком хранения один год и менее пробы на стабильность следует отбирать и испытывать ежемесячно в течение первых 3 мес. и затем с интервалом в 3 мес.
При наличии данных, подтверждающих сохранение стабильности АФС, может быть рассмотрен вопрос об увеличении периодичности испытаний (например, проведение испытаний через 9 мес.).
11.56. Условия хранения при проведении испытаний на стабильность должны, по возможности, соответствовать требованиям нормативной документации к проведению этих испытаний.
11.6. Срок годности и дата повторного контроля
11.60. Если промежуточный продукт предназначен для перемещения за пределы зоны действия системы управления качеством производителя и для этого продукта установлен срок годности или дата проведения повторного контроля, то следует иметь данные по его стабильности (например, опубликованную информацию, результаты испытаний).
11.61. Срок годности АФС и дата повторного контроля должны быть основаны на результатах анализа данных, полученных при испытаниях на стабильность. Обычно для АФС используют дату повторного контроля, а не дату срока годности.
11.62. Определение предварительного срока годности или даты повторного контроля АФС может основываться на данных производства опытных серий в следующих случаях:
1) при производстве опытных серий использовались методы, моделирующие технологический процесс при промышленном производстве;
2) качество АФС соответствует качеству продукции, которая будет производиться в промышленном масштабе.
11.63. Для проведения повторного контроля должен использоваться образец, репрезентативный для этой серии.
11.7. Архивные образцы
11.70. Упаковка и хранение архивных образцов предназначены для возможной оценки качества серий АФС в будущем, а не для проведения испытаний этих образцов на стабильность.
11.71. Маркированные архивные образцы из каждой серии АФС следует сохранять не менее одного года после истечения срока годности данной серии, определенного производителем, или в течение трех лет после даты реализации этой серии, в зависимости от того, какой срок больше. Для АФС с датой повторного контроля аналогичные архивные образцы следует хранить в течение трех лет после того, как эта серия была полностью реализована производителем.
11.72. Архивные образцы должны храниться в такой же или в эквивалентной упаковке, используемой для АФС, либо в упаковке, более защищенной, чем упаковка, в которой реализуется эта продукция. Количество архивных образцов должно быть достаточным для проведения не менее двух полных анализов в соответствии с требованиями Фармакопеи либо, в случае отсутствия соответствующей фармакопейной статьи, двух полных анализов согласно спецификации.