чем залечить раны при диабете 2 типа
Как и чем обработать раны при диабете?
Незначительная ранка или порез – мелочь для здорового человека. Для диабетиков всё обстоит иначе
Незначительная ранка или порез – мелочь для здорового человека. Для диабетиков всё обстоит иначе: любое повреждение мягких тканей заживает намного дольше, а риск инфицирования повышается в разы. Правильный уход за повреждённым участком – основа предупреждения нежелательных осложнений.
Принципы ухода за ранами для диабетиков
Сахарный диабет нарушает нормальную жизнедеятельность организма. Под угрозой: обменные процессы, функционирование сердечно-сосудистой системы, внутренних органов, состояние кожи, слизистой. Регенерация тканей у диабетиков также нарушается.
Длительно незаживающая рана при сахарном диабете – не только неудобно, но и опасно. Ослабленный организм больного не в состоянии активно противостоять болезнетворным бактериям, поэтому риск инфицирования повреждённого места и загноения повышается в несколько раз.
Своевременная и правильная обработка раны – основа предупреждения осложнений для диабетиков. Привычный алгоритм действий (йод – пластырь) в данном случае не подойдёт.
При мельчайших порезах, ранках, необходимо:
Стерильная повязка защищает рану от загрязнений и предупреждает занесение инфекции. Перевязки необходимо выполнять регулярно.
Специальные мази для обработки ран
Крайне важно постоянно контролировать процесс заживления. Внимательно осматривайте рану при каждой перевязке, обращайте внимание на любые изменения. Ускорить восстановление повреждённых тканей поможет местное лечение.
Рекомендуется использовать препараты, содержащие в составе аллантоин, инсулин и мочевину. Они улучшают местный метаболизм, снижают негативное воздействие глюкозы на клетки. К таким мазям относят Диа Дерм, гепариновую и инсулиновую.
Благотворное влияние на восстановительный процесс оказывают мази на жировой основе. Они питают и увлажняют поражённые участки, ускоряют рост здоровых тканей. В данную группу препаратов входят Метилурацил, Солкосерил.
Предотвращают развитие грибковых поражений. Мазь Уреата устраняет грибковые поражения, а мочевина в составе активно питает кожу. Мазь Вирта обладает широким спектром действия. Она борется с сухостью кожи, воспалением, вызванным грибковой инфекцией.
Применять ту или иную мазь следует только после консультации с врачом и строго по предназначению. Важно убедиться, что в составе препарата отсутствует спирт, красители, салициловая кислота. Для ускорения восстановления к наружным средствам подключают приём витаминов и минералов. Они повышают тонус организма, улучшают обменные процессы.
Болезни кожи при сахарном диабете
Тяжелые метаболические нарушения, лежащие в основе патогенеза сахарного диабета (СД), приводят к изменениям почти во всех органах и тканях организма, в том числе и в коже. Этиология кожных поражений
Тяжелые метаболические нарушения, лежащие в основе патогенеза сахарного диабета (СД), приводят к изменениям почти во всех органах и тканях организма, в том числе и в коже. Этиология кожных поражений при СД, безусловно, связана с нарушением углеводного обмена и накоплением соответствующих продуктов нарушенного метаболизма, что приводит к структурным изменениям в дерме, эпидермисе, фолликулах и потовых железах. В сочетании с диабетической полинейропатией, микро- и макроангиопатиями, нарушением местного и общего иммунитета это приводит к появлению различных видов сыпи, пигментных пятен, изъязвлений, а также к гнойно-септическим осложнениям.
Кожа больных СД подвергается своеобразным изменениям общего характера. При тяжелом течении болезни она становится грубой на ощупь, тургор ее снижается, развивается значительное шелушение, особенно волосистой части головы. Волосы теряют свой блеск. На подошвах и ладонях возникают омозолелости, трещины. Нередко развивается выраженное желтоватое окрашивание кожных покровов. Ногти деформируются и утолщаются за счет подногтевого гиперкератоза. Диффузное выпадение волос может быть симптомом плохо контролируемого диабета.
Часто дерматологические проявления могут выступать в качестве «сигнальных признаков» СД: зуд кожи, сухость слизистых и кожи, рецидивирующие кожные инфекции (кандидоз, пиодермии).
В настоящее время описано более 30 видов дерматозов, которые либо предшествуют СД, либо развиваются на фоне манифестного заболевания. Условно их можно разделить на 3 группы:
Как правило, диабетические поражения кожи имеют длительное и упорное течение с частыми обострениями и трудно поддаются лечению.
Диабетическая дерматопатия. Наиболее частое поражение при диабете выражается в появлении на передней поверхности голеней симметричных красновато-коричневых папул диаметром 5–12 мм, которые затем превращаются в пигментированные атрофические пятна (чаще выявляется у мужчин с большой длительностью СД). Субъективные симптомы отсутствуют, течение длительное, могут исчезать самостоятельно в течение 1–2 лет. Патогенез связан с диабетической микроангиопатией. Специфическое лечение дерматопатии не проводится.
Диабетический пузырь. Относится к редким поражениям кожи при СД. Пузыри возникают внезапно, без покраснения, на пальцах рук и ног, а также на стопе. Размеры варьируют от нескольких миллиметров до нескольких сантиметров. Пузырная жидкость прозрачна, иногда геморрагична и всегда стерильна. В большинстве случаев пузыри заживают без рубцевания через 2–4 нед симптоматического лечения.
Рубеоз. В детском и юношеском возрасте у больных инсулинозависимым СД на коже лба, щек (реже — подбородка) наблюдается гиперемия в виде небольшого румянца, что иногда сочетается с поредением бровей.
Диабетическая эритема. Протекает по типу эфемерных эритематозных пятен, которые наблюдаются в основном у мужчин старше 40 лет, страдающих диабетом в течение непродолжительного времени. Эти пятна характеризуются крупными размерами, резкими границами, округлыми очертаниями и насыщенной розово-красной окраской. Локализуются в основном на открытых кожных покровах — лице, шее, тыле кисти. Субъективные ощущения либо отсутствуют, либо больные жалуются на легкое покалывание. Пятна отличаются весьма непродолжительным сроком существования (2–3 дня), исчезают самопроизвольно.
Acanthosis nigricans. Характеризуется ворсинчатыми гиперпигментированными разрастаниями, преимущественно в складках шеи и подмышечной впадине. Больные жалуются на «грязную кожу», которую невозможно отмыть. На самых выступающих точках суставов пальцев иногда также имеются мелкие папулы. В основе патогенеза лежит выработка печенью инсулиноподобных факторов роста, которые вступают в связь с эпидермальными рецепторами и вызывают утолщение эпидермиса и гиперкератоз.
Диабетическая ксантома. Развивается на фоне гиперлипидемии, причем основную роль играет увеличение содержания в крови триглицеридов. Желтоватые бляшки локализуются преимущественно на сгибательных поверхностях конечностей, на груди, лице, шее и состоят из скопления триглицеридов и гистиоцитов.
Липоидный некробиоз. Относительно редкий хронический дерматоз, характеризующийся очаговой дезорганизацией и липидной дистрофией коллагена.
Инсулинозависимый СД является наиболее частой причиной липоидного некробиоза и встречается у 1–4% таких больных. Кожные проявления могут быть первыми — и долгое время единственными — проявлениями диабета. Полагают, что у 18–20% больных липоидный некробиоз может возникнуть за 1–10 лет до развития типичных симптомов диабета, у 25–32% больных развивается одновременно с этим заболеванием, однако у большинства (55–60%) СД предшествует поражению кожи. Прямой зависимости выраженности клинических проявлений липоидного некробиоза от тяжести течения диабета не существует.
Заболевание может возникнуть в любом возрасте, однако чаще ему подвержены лица от 15 до 40 лет (преимущественно женщины). Протекает на фоне инсулинзависимого диабета и характеризуется крупными единичными очагами поражения на коже голеней. Заболевание обычно начинается с появления небольших синюшно-розовых пятен или гладких плоских узелков округлых или неправильных очертаний, склонных к периферическому росту с последующим формированием четко отграниченных, вытянутых по длине овальных или полициклических индуративно-атрофических бляшек. Их центральная часть (желтовато-коричневого цвета) слегка западает, а краевая часть (синюшно-красная) несколько возвышается. Бляшки имеют гладкую поверхность, иногда шелушащуюся по периферии. Постепенно центральная часть бляшек атрофируется, на ней появляются телеангиоэктазии, легкая гиперпигментация, иногда изъязвления. Субъективных ощущений, как правило, нет. Боль возникает при изъязвлении.
Внешний вид очагов настолько характерен, что обычно дополнительных исследований не требуется. При атипичных формах проводят дифференциальный диагноз с кольцевидной гранулемой, саркоидозом, ксантоматозом.
Эффективного лечения в настоящее время нет. Применяются средства, нормализующие липидный обмен (Липостабил, Клофибрат, Бензафлавин); улучшающие микроциркуляцию (Курантил, Трентал, Теоникол). Показаны такие препараты, как Аевит, Дипромоний, Никотинамид, Ангиотрофин. Эффективно внутриочаговое введение кортикостероидов, инсулина, Гепарина. Наружно: аппликации 25–30% раствора Димексида, нанесение Троксевазиновой, Гепариновой мазей, наложение окклюзивных повязок с фторсодержащими кортикостероидными мазями. Физиотерапия: фонофорез гидрокортизона, электрофорез Аевита, Трентала. Лазеротерапия: при изъязвлении иногда прибегают к оперативному вмешательству (удалению очагов с последующей кожной пластикой).
Зудящие дерматозы (зуд кожи, нейродермит). Часто являются первыми признаками диабета. Не наблюдается прямой зависимости между тяжестью СД и интенсивностью зуда. Наоборот: замечено, что наиболее сильный и упорный зуд наблюдается при скрытой и легкой формах диабета. У большинства пациентов кожный зуд предшествует развитию не только поражения кожи при СД, но и самому установлению диагноза (от 2 мес до 7 лет). Реже зуд развивается уже на фоне установленного и леченого СД.
Преимущественной локализацией являются складки живота, паховые, межъягодичная, локтевые. Поражения часто односторонние.
Грибковые поражения кожи. Наиболее часто развивается кандидоз, обычно вызываемый Candida albicans. Чаще встречается в пожилом возрасте и у тучных пациентов с преимущественной локализацией очагов в области гениталий и крупных складок кожи, межпальцевых складок, слизистых оболочек (вульвовагинит, баланопастит, ангулярный хейлит). Кандидомикоз может играет роль «сигнального симптома» СД.
Кандидоз любой локализации начинается с сильного и упорного зуда, в дальнейшем к нему присоединяются объективные признаки заболевания. Сначала в глубине складки появляется белесоватая полоска мацерированного рогового слоя, формируются поверхностные трещины и эрозии. Поверхность эрозий — влажная, блестящая, синюшно-красного цвета, окаймленная белым ободком. Вокруг основного очага появляются «отсевы», представленные мелкими поверхностными пузырьками и пустулами. Вскрываясь, эти элементы превращаются в эрозии, также склонные к росту и слиянию. Диагноз подтверждается при микроскопическом или культуральном исследовании.
Для местного лечения применяются проверенные временем, простые и доступные средства — спиртовые или водные (последние лучше для крупных складок) растворы анилиновых красителей: метиленовой синьки (2–3%), бриллиантовой зелени (1%), а также жидкость Кастеллани, мази и пасты, содержащие 10% борной кислоты. Из местных антимикотиков можно использовать практически любые в виде 1–2% кремов, мазей, растворов. Наружные средства применяют до полного разрешения кожных очагов, а затем еще в течение одной недели. Из системных антимикотиков применяются флуконазол, итраконазол или кетоконазол. Флуконазол назначают по 150 мг/сут однократно, при торпидном течении, по 150 мг/сут 1 раз в неделю в течение 2–3 нед. Итраконазол назначают по 100 мг/сут в течение 2 нед или по 400 мг/сут в течение 7 дней. Кетоконазол назначают по 200 мг/сут в течение 1–2 нед. Целесообразность назначения системных антимикотиков определяется эффективностью, предшествующей терапии, мотивацией пациента, желающего как можно скорее избавиться от проявлений болезни, а также доступностью препаратов.
Инфекционные заболевания. Бактериальные поражения кожи встречаются у больных СД значительно чаще, чем в популяции и трудно поддаются лечению. Диабетические язвы стопы являются наиболее грозным осложнением и могут приводить к ампутации конечности и даже летальному исходу.
В заключение следует отметить, что поражения кожи при диабете являются на сегодняшний день распространенными состояниями, достаточно часто встречающимися в клинической практике. Лечение их имеет определенные трудности и должно начинаться с эффективного контроля за уровнем сахара в крови и отработкой адекватной схемы приема антидиабетических препаратов. Без коррекции углеводного обмена у этой группы пациентов все лечебные мероприятия малоэффективны.
Литература
И. Б. Мерцалова, кандидат медицинских наук
РМАПО, Москва
Применение новых технологий в лечении синдрома диабетической стопы: клинический случай
Синдром диабетической стопы (СДС) — очень серьезное осложнение сахарного диабета (СД). Это осложнение (в 85% случаев представленное трофическими язвами стоп разной тяжести) выявляется у 4—10% от общего числа пациентов с СД.
Синдром диабетической стопы (СДС) — очень серьезное осложнение сахарного диабета (СД). Это осложнение (в 85% случаев представленное трофическими язвами стоп разной тяжести) выявляется у 4—10% от общего числа пациентов с СД. Бытует мнение, что эффективность лечения язвенных дефектов стоп при СД низка, однако это не соответствует действительности. На самом деле при нейропатической форме (50—70% всех больных СДС) заживление трофической язвы происходит в 80—90% случаев. Для этого необходимо соблюдение нескольких обязательных условий (см. таблицу 1), тогда как низкая эффективность лечения часто связана с тем, что условия соблюдаются не полностью. Как показывает практика последних 10 лет, появление специализированных отделений и кабинетов «Диабетической стопы» значительно повысило эффективность лечения этих пациентов и снизило число ампутаций. Одна из не решенных пока проблем, актуальных для таких специализированных отделений, — низкая эффективность консервативного лечения диабетических язв при (нейро)ишемической форме СДС.
Ишемическая и нейроишемическая формы составляют менее половины всех случаев СДС (5—10% и 25—40%, соответственно) (Дедов, 1998, Shаw, 1996; Международная рабочая группа по диабетической стопе, 2000; Staroverova, 2001). Однако наличие выраженной ишемии принципиально меняет прогноз лечения у этих пациентов: вероятность заживления язвенных дефектов без восстановления магистрального кровотока составляет 10—30% (Международная рабочая группа по диабетической стопе, 2000). Следует помнить, что назначение большинства вазоактивных средств не повышает вероятность заживления язвенных дефектов. Согласно данным метаанализа (Loosemore, 1994), непростаноидные препараты (эффективные при II стадии хронической артериальной недостаточности, ХАН) неэффективны при III-IV стадиях. Простаниоды (алпростадил, илиопрост) влияют на прогноз при III-IV стадиях ХАН, но в основном — у больных с умеренными проявлениями критической ишемии (tcpO2>20 mmHg). Прогрессирование поражения и отсутствие заживления ран после малых ампутаций на фоне критической ишемии приводят к высокой ампутации у значительной части пациентов. Однако хорошо известно, что проведенное в таких условиях реконструктивное вмешательство на артериях нижних конечностей кардинально меняет прогноз лечения, позволяет избежать высокой, а в ряде случаев — и малой ампутации. Это привело к тому, что в последние годы хирургическая реконструкция артерий (путем шунтирования или эндоваскулярных вмешательств) рассматривается в качестве метода выбора при лечении как перемежающейся хромоты, так и язвенных дефектов ишемического происхождения при СД (American Diabetes Association, 1999; Международная рабочая группа по диабетической стопе, 2000). Была показана высокая эффективность реконструктивных операций у пациентов с СД, в ряде случаев сопоставимая с таковой у пациентов без нарушений углеводного обмена. Результатом широкого внедрения этих методов в зарубежных странах явилось значительное снижение числа ампутаций при ишемической форме синдрома диабетической стопы в Европе. Реконструктивные операции на артериях у больных сахарным диабетом проводятся и в России (Покровский, 2002; Гавриленко, 2002; Мухамадеев, 2002).
Еще один недавно вошедший в практику метод лечения — иммобилизирующая разгрузочная повязка (ИРП), в зарубежной литературе — Total Contact Cast. Такая фиксирующая повязка на голень и стопу представляет собой более или менее жесткий «сапожок» (из гипса или современных полимерных материалов, съемный или несъемный), переносящий нагрузку с области язвы на другие участки. Важно, что этот метод позволяет ходить по улице, работать и т. п., не подвергая при этом рану механической нагрузке. В большинстве зарубежных стран ИРП стал «золотым стандартом» разгрузки, но в России он практически не применялся из-за боязни возникновения осложнений (не всегда обоснованной). В нашей стране основным, хорошо себя зарекомендовавшим методом разгрузки сегодня является «полубашмак». Однако в ряде ситуаций «полубашмак» оказывается неэффективен либо существуют противопоказания к его применению. Это расположение язвы в средней части стопы или пяточной области, необходимость выходить на улицу, работать, а также несоблюдение пациентом предписанного режима разгрузки. В этих случаях требуется использование ИРП.
Пациент В., 57 лет, обратился за консультацией в отделение «Диабетическая стопа» ЭНЦ РАМН 15.04.2003. Диагноз: сахарный диабет 2 типа, тяжелого течения, декомпенсация. Диабетическая дистальная полинейропатия. Диабетическая макроангиопатия: атеросклероз артерий нижних конечностей, критическая ишемия левой нижней конечности (ХАН IV ст). Синдром диабетической стопы, нейроишемическая форма: инфицированный язвенный дефект левой пяточной области II-III cт. по Wagner. Диабетическая микроангиопатия: диабетическая нефропатия в стадии протеинурии с сохранной азотовыделительной функцией почек (IV ст. по Morgensen); диабетическая ретинопатия II ст. ИБС, стенокардия напряжения I ф. к. Многоузловой эутиреоидный зоб 0 ст. (ВОЗ).
СД 2 типа диагностирован в 1990 г. Пациент получал лечение диабетоном 80 мг 1-2 таб/сут (принимал препарат нерегулярно), контроль гликемии был нерегулярным. На момент осмотра уровень гликемии достиг 17,5 ммоль/л натощак.
Перемежающуюся хромоту не отмечал (однако вел малоподвижный образ жизни, редко проходил более 500 м).
23.02.2003 появился язвенный дефект левой пяточной области. Рана не заживала, несмотря на проводившееся амбулаторное и стационарное лечение (включавшее вазапростан 40 мкг/сут N 15), осложнилась раневой инфекцией (St. aureus, Enterococcus).
 |
| Рисунок 1. Исходный вид раны. |
На момент осмотра: рана 4,5 х 3,5 см, глубиной до 3 см (см. рисунок 1). Стопа отечна, теплая на ощупь. Вибрационная чувствительность на стопах = 0-1 балл, пульсация на артериях правой стопы ослаблена, левой — не определяется.
Общее состояние: относительно удовлетворительное, температура тела в норме. ЧСС = 70 уд/мин, АД = 140—150/80—90 mmHg.
Рентгенологически: дефект мягких тканей пяточной области, признаков деструкции пяточной кости нет.
УЗДГ: справа — признаки стеноза
50% бедренно-подколенного сегмента, артерий голени. Слева — стенотические изменения бедренно-подколенного сегмента (
50%), окклюзия передней тибиальной артерии, субтотальный стеноз задней большеберцовой артерии.
Дуплексное сканирование брюшного отдела аорты и артерий нижних конечностей (в ГКБ №81): сосудистая стенка неровная, утолщена в дистальных сегментах обеих задних большеберцовых артерий (ЗББА) с медиокальцинозом. Толщина комплекса «интима-медиа» до 1,2 мм. В просвете дистальных сегментов ЗББА — множественные микрокальцинаты, стенозирование ЗББА справа до 90%, слева до 80%.
Восстановление артериального кровотока
На основании данных обследования и с учетом неэффективности проводившейся консервативной терапии, пациент был направлен к ангиохирургу для проведения реконструктивного вмешательства на артериях нижней конечности. Указанное лечение осуществлялось в 25-м Центральном военном клиническом госпитале РВСН с 13.05.03 по 02.06.03.
При обследовании в стационаре были получены следующие данные.
Клинический анализ крови: гемоглобин — 128 г/л, эритр. — 4,36*10 12 /л, лейк. — 6,8*10 9 /л (пал. — 2%, сегм. — 62%, эоз. — 2%, лимф. — 28%, мон. — 6%), СОЭ — 23 мм/ч.
Клинический анализ мочи: уд. вес — 1014, белок — 1,22%, цил. — нет, лейк. — 2—4 в п/зр, эритр. — 3—5 в п/зр.
Биохимический анализ крови: общий белок — 69,0 ммоль/л, билирубин — 10,0 ммоль/л, креатинин — 120 мкмоль/л, мочевина — 6,1 ммоль/л, холестерин — 4,8 ммоль/л, β-липопротеиды — 40%, триглицериды — 1,0 ммоль/л, АЛТ, АСТ — в норме.
ЭКГ: ритм синусовый, правильный, 68 уд/мин. Горизонтальное положение электрической оси сердца.
Ro-графия органов грудной клетки: легочные поля прозрачны. Корни фиброзные, с петрификатами. Гипертрофия левого желудочка, уплотнена дуга аорты.
УЗИ органов брюшной полости: печень, селезенка, желчный пузырь, поджелудочная железа, почки — без патологических изменений.
Ангиография артерий нижних конечностей: абдоминальный отдел аорты с неровными контурами, просвет ее сохранен. Контуры магистральных артерий нижних конечностей неровные, просвет сохранен, выраженный кальциноз стенок артерий. Магистральные артерии обеих голеней с неровными контурами, резко истончаются ниже уровня щели голеностопных суставов. В дистальном отделе левой задней большеберцовой артерии определяются два тандемных критических стеноза. Подошвенные артериальные дуги разомкнуты.
Проведенное лечение
Антибиотикотерапия (офлоксацин 200 мг два раза в день), хирургическая обработка раны (иссечение некротизированных тканей из кармана глубиной до 3 см), дезинтоксикационная терапия, дезагреганты в/в. Пациент переведен на инсулинотерапию (актрапид 8 ЕД п/з, 6 ЕД п/о, 6 ЕД п/у; монотард 8 ЕД п/з, 8 ЕД — 22.00), достигнута компенсация углеводного обмена (гликемический профиль 25.06.03: 8,9–6,5–4,7–7,4–5,1 ммоль/л). В связи с диабетической нефропатией IV ст. пациент постоянно получает эналаприл 10 мг/сут.
20.05.03 произведена рентгеноэндоваскулярная ангиопластика задней большеберцовой артерии слева, восстановлен артериальный кровоток.
Операция проводилась под местной анестезией 0,5%—20,0 Sol. Novocaini, левосторонним чрезбедренным доступом антеградно пунктирована бедренная артерия. Через интродюсер диаметром 5F введен коронарный проводник в заднюю большеберцовую артерию дистальнее стенозов. В область критических стенозов подведен баллонный сегмент катетера размерами 2, 5×20, 0 мм. Выполнена ангиопластика под рабочим давлением до 5 атм. На контрольной ангиограмме стеноз устранен, препятствий для кровотока не определяется. Проводник удален. Интродюсер подшит к коже. Асептическая повязка. За период вмешательства больному внутриартериально введено 7 тыс. ЕД гепарина. Состояние пациента не изменилось.
После выписки: при допплеровском исследовании магистрального кровотока справа и слева в задних большеберцовых артериях — магистральный измененный кровоток (ЛПИ > 1), в тыльных артериях стопы — коллатеральный кровоток, но ЛПИ > 1 (возможно завышение лодыжечно-плечевого индекса, вследствие артериосклероза Менкеберга).
Чрескожное напряжение кислорода (tcpO2) на тыльной стороне левой стопы (через три месяца после ангиопластики): лежа — 19 mmHg, сидя — 20 mmHg (возможно занижение показателя вследствие отека стопы). По совокупности клинических данных, состояния раны и результатов инструментального обследования было сделано заключение, что явления критической ишемии устранены.
Применение индивидуальной разгрузочной повязки (Total Contact Cast)
Пациент был выписан для амбулаторного лечения, которое включало:
Признаков ишемии конечности не наблюдалось, рана заполнилась полноценной грануляционной тканью (см. рисунок 2), но скорость сокращения размеров раны оказалась ниже расчетной (см. рисунок 3).
Известно, что скорость заживления соответствует расчетной при отсутствии значимой ишемии, инфекции и механической нагрузки на рану. Учитывая, что разгрузка конечности с применением костылей не является оптимальной, было решено изготовить иммобилизирующую разгрузочную повязку.
 |
| Рисунок 3. Оценка скорости уменьшения размеров раны. |
Эквивалентный радиус раны рассчитывается как (d1+d2)/4, где d1 и d2 — соответственно максимальный и перпендикулярный ему минимальный диаметр раны.
Реальные размеры раны наносились на график (красная линия) при каждом осмотре пациента (точка «0» — 1 месяц после баллонной ангиопластики). Из графика видно, что после изготовления ИРП скорость заживления (угол наклона графика) значительно выросла и достигла расчетной.
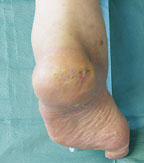 |
| Рисунок 4. Вид стопы пациента по окончании лечения. |
При применении этого метода разгрузки рана начала затягиваться гораздо быстрее, и к 10.09.03 было достигнуто заживление язвы (см. рисунок 4).
Основными методами реваскуляризации нижних конечностей являются шунтирующие операции и чрескожная транслюминальная баллонная ангиопластика (ЧТБА). Зачастую ЧТБА считают недостаточно эффективной и предлагают не использовать у пациентов с СД. Известно, что долговременный эффект шунтирования выше, чем у баллонной ангиопластики, причем у больных с СД эта разница выражена сильнее (Dyet, 2000). Но в критических ситуациях (язвенные дефекты, критическая ишемия) ангиопластика представляет собой малоинвазивный метод, позволяющий стабилизировать ситуацию и избежать ампутации, что зачастую более важно, чем отдаленные результаты вмешательства. Это так называемая limb-saving angioplasty — ангиопластика для спасения конечности.
На выбор метода в значительной мере влияет локализация поражения. Показано, что ЧТБА более эффективна при стенозах подвздошных и бедренных артерий. При стенозах подколенной артерии и артерий голени ЧТБА сопряжена с рядом трудностей и в целом менее действенна (хотя есть сообщения (Grаziаni, 2001) о 70-80-процентной эффективности вмешательства). Поэтому при стенозах артерий голени методом выбора в развитых странах стало шунтирование, тогда как при более серьезном уровне поражения — ЧТБА (Trans-Atlantic Inter-Society Consensus Group, 2000). Шунтирование на дистальных артериях, потребовавшее совершенствования техники операции, в последние годы превратилось в реальность. В некоторых ситуациях ЧТБА технически трудна и может оказаться неосуществимой. Это, например, случаи полной окклюзии сосуда и большой протяженности поражения. Принципы выбора между шунтированием и ЧТБА в этих ситуациях детально описаны в специальной литературе (Trans-Atlantic Inter-Society Consensus Group, 2000; Коков, 2002).
Однако в ряде случаев шунтирующие операции противопоказаны в связи с тяжелым общим состоянием пациента, а также при наличии трофической язвы с выраженной раневой инфекцией. У таких больных «ангиопластика для спасения конечности» абсолютно обоснованна. Такое вмешательство позволяет достичь заживления раны, а через несколько лет, если произойдет ухудшение проходимости артерий, направить пациента на шунтирующую операцию. Имеются многочисленные сообщения о хорошем лечебном эффекте ЧТБА (в том числе на артериях голени) при критической ишемии конечности у больных с СД (Воmmаyyа, 2002; Dyet, 2000; Сittеriо, 2000; Fаgliа, 2000), включая результаты одного многоцентрового исследования (Grаziаni, 2001).
История болезни, представленная выше, демонстрирует также, как важна постоянная оценка эффективности проводимого лечения (в нашем случае — сопоставление динамики размеров язвы с результатами расчета по формуле Cavanagh). Если эффект от лечения недостаточен, необходимо выявить причину, по которой это происходит. В нашем случае отсутствие оптимального режима разгрузки оказалось достаточной причиной для замедленного заживления раны, и эта проблема могла быть решена только с помощью нового метода — иммобилизирующей разгрузочной повязки. Следует особенно отметить, что для приближения к «идеальной» скорости заживления не потребовалось использования ни «стимуляторов заживления» (солкосерил, актовегин, метилурацил и т. п.), ни «сосудистых» средств. Эти препараты широко применяются, однако их эффективность в отсутствии необходимых условий для заживления (см. таблицу 1) крайне низка.
В настоящее время становятся доступными новые методы лечения СДС, внедрение которых в повседневную практику вполне возможно и крайне необходимо. Только адекватное комбинированное лечение позволяет достичь оптимальных результатов, особенно в сложных случаях, таких, как синдром диабетической стопы.
По вопросам литературы обращайтесь в редакцию
О. В. Удовиченко, кандидат медицинских наук
Г. Р. Галстян, кандидат медицинских наук
И. А. Ерошкин, кандидат медицинских наук
А. А. Ефимов, О. В. Носов
Ю. Г. Васильев, кандидат медицинских наук
Эндокринологический научный центр РАМН (Москва), 25-й Центральный военный клинический госпиталь РВСН (Одинцово)

