чем дышит новорожденный ребенок
Реанимация и интенсивная терапия новорожденных с асфиксией
Общепринятого определения асфиксии новорожденного пока не существует. Наиболее информативной и объективной представляется дефиниция асфиксии, представленная Н. П. Шабаловым и соавторами (2003). Они считают асфиксией новорожденного синдром, характеризующ
Общепринятого определения асфиксии новорожденного пока не существует. Наиболее информативной и объективной представляется дефиниция асфиксии, представленная Н. П. Шабаловым и соавторами (2003). Они считают асфиксией новорожденного синдром, характеризующийся отсутствием эффективности газообмена в легких сразу после рождения, неспособность самостоятельно дышать при наличии сердцебиений и (или) других признаков живорожденности (спонтанное движение мышц, пульсация пуповины).
До середины 1980-х гг. основным критерием диагностики асфиксии была оценка по шкале Апгар, что нашло отражение в Международной классификации болезней 9-го пересмотра (1975). Однако в 1986 г. Американская академия педиатрии и Американский колледж акушеров и гинекологов на основании многочисленных катамнестических исследований пришли к заключению о том, что баллы по шкале Апгар через 1 и 5 мин после рождения слабо коррелируют как с причиной данного состояния, так и с прогнозом и сами по себе не должны рассматриваться как показатели проявления или последствия асфиксии.
В то же время при состоянии с низкой оценкой по шкале Апгар (0–3 балла), сохраняющемся в течение 15 мин, детский церебральный паралич наблюдается у 10%, а в течение 20 мин — у 60% пациентов.
Несмотря на критическое отношение к шкале Апгар и вопреки мнению о том, что она не должна рассматриваться в качестве критерия диагностики и степени тяжести асфиксии в родах (Н. П. Шабалов и соавт., 2003), целесообразо обратиться непосредственно к Международной классификации болезней 10-го пересмотра (1993).
Рубрика Р 21. Асфиксия при родах
Примечание. Эту рубрику не следует использовать при низких показателях по шкале Апгар без упоминания об асфиксии и других дыхательных расстройствах.
Р 21.0. Тяжелая асфиксия при рождении.
Пульс при рождении менее 100 уд./мин, замедляющийся или устойчивый, дыхание отсутствует или затруднено, кожа бледная, мышцы атоничны. Асфиксия с оценкой по шкале Апгар 0–3 балла через минуту после рождения. Белая асфиксия.
Р 21.1. Средняя и умеренная асфиксия при рождении.
Нормальное дыхание в течение первой минуты после рождения не установилось, но частота сердцебиений составляет 100 уд./мин или более, незначительный мышечный тонус, незначительный ответ на раздражение.
Оценка по шкале Апгар 4–7 баллов через минуту после рождения. Синяя асфиксия.
Различают также острую асфиксию, являющуюся проявлением интранатальной гипоксии, и асфиксию, развившуюся на фоне хронической внутриутробной антенатальной гипоксии.
Частота встречаемости асфиксии новорожденных, по данным различных авторов, колеблется в весьма широких пределах, что, очевидно, связано с отсутствием общепринятой дефиниции. Так, Саrter и соавторы (1993) полагают, что частота асфиксии составляет 1–1,5%. Еще в 10–15% случаев низкая оценка по шкале Апгар оказывается обусловлена кардиореспираторной депрессией. В сумме названные состояния составляют до 16,5%. Примерно такие же показатели за 2003 г. опубликованы Министерством здравоохранения и социального развития РФ. При этом летальность от асфиксии среди доношенных детей составляет 0,2%, а среди недоношенных — 1,16%.
По данным С. Г. Эзутаган (1999), частота перинатальной асфиксии у недоношенных детей составляет 30%, а у доношенных новорожденных — 20%.
Н. Н. Володин и С. О. Рогаткин (2004) сообщают, что ежегодно в мире рождаются в состоянии асфиксии 4 млн детей: 840 тыс. из них умирают, еще столько же в дальнейшем страдают от стойких нарушений функциональной деятельности центральной нервной системы.
Выделяют пять главных причин асфиксии новорожденного.
Гипоксемия, гиперкапния и связанный с ними ацидоз являются ведущими звеньями патогенеза асфиксии. Они активируют гемодинамическое перераспределение объемов крови, секрецию гормонов стрессового типа, продукцию цитокинов, молекул адгезии и факторов роста, каскадную систему плазменных протеаз. Эти же факторы после реоксигенации активируют перекисное окисление липидов клеточных мембран с образованием метаболитов арахидоновой кислоты (простагландинов и лейкотриенов) и повышением содержания клеточных метаболитов (аденозина, оксида азота, эндотелина и др.).
Напряжение кислорода в крови ниже 40 мм рт. ст. включает так называемый «ишемический рефлекс», хеморецепторный механизм которого приводит к возбуждению одновременно вазомоторного и дыхательного центров, централизации кровообращения, т. е. ишемии кожи, легких, почек, печени, желудочно-кишечного тракта, ради обеспечения жизненно важных органов (сердца, мозга, диафрагмы, надпочечников).
В процессе централизации кровообращения, кроме адреналина и норадреналина, участвуют ангиотензин II и вазопрессин.
Высокое сопротивление сосудов малого круга, поддерживаемое гипоксемией и гиперкапнией, является причиной легочной гипертензии и шунтирования крови, дыхательной недостаточности, а также перегрузки правых отделов сердца давлением, а левых отделов — объемом.
Отрицательным эффектом гипоксемии, гиперкапнии и централизации кровообращения является накопление недоокисленных продуктов и тяжелый смешанный ацидоз. Компенсаторная активация анаэробного гликолиза с накоплением лактата еще больше усиливает ацидоз. Последний крайне отрицательно влияет на системную гемодинамику, микроциркуляцию, гемореологию, водно-электролитный баланс, обменные процессы.
Нарастание гипоксии и смешанного ацидоза вызывает раскрытие прекапиллярных сфинктеров, децентрализацию кровообращения с падением артериального давления, т. е. гемодинамический коллапс, снижающий тканевую перфузию в жизненно важных органах.
В сосудах ишемизированных тканей активизируются тромбоциты, эндотелиоциты, моноциты, что приводит к активации каскада плазменных протеаз, а также освобождению клеточных ферментов, про- и антикоагулянтов, метаболитов арахидоновой кислоты, активных форм кислорода и оксида азота, которые причастны к повреждению функции органов.
Активация тромбиновой, фибринолитической, кининовой и системы комплемента ведет к эндотоксикозу продуктами протеолиза и наряду с ацидозом — к повреждению мембран клеток, митохондрий, лизосом, гематоэнцефалического барьера, повышению сосудистой проницаемости, падению сосудистого тонуса, деструкции клеток, отеку интерстициального пространства, сладж-феномену, запуску внутрисосудистого свертывания, тромбозу, блокаде микроциркуляции, дистрофическим процессам, в конечном счете — к полиорганной недостаточности.
Клинические признаки и симптомы
При асфиксии средней тяжести ребенок рождается с апноэ или с единичными гаспами, с частотой сердцебиений 90–160 уд./мин, со сниженным мышечным тонусом и рефлекторным ответом на назофарингеальный катетер, с выраженным цианозом (синяя асфиксия). Общее состояние оценивается как тяжелое или средней тяжести. В первые минуты жизни ребенок вял, быстро охлаждается. Слабо реагирует на осмотр и раздражения. Спонтанная двигательная активность низкая. Физиологические рефлексы угнетены. При аускультации сердца часто выявляют тахикардию, приглушенность тонов, акцент II тона над легочной артерией. Дыхание нередко с участием вспомогательной мускулатуры, аускультации — ослабленное, с обилием сухих и разнокалиберных влажных хрипов.
Нередко уже в первые часы жизни появляются гипервозбудимость, крупноразмашистый тремор рук, гиперстезия, спонтанный рефлекс Моро, кратковременные судороги. В то же время у некоторых пациентов нарастают клинические признаки угнетения центральной нервной системы. Динамика мышечного тонуса, физиологические рефлексы, признаки угнетения или повышенной возбудимости нервной системы весьма индивидуальны и во многом зависят от адекватности оказания помощи.
Тяжелая асфиксия характеризуется наличием при рождении признаков II или III стадии шока: дыхание отсутствует или наблюдаются неэффективные гаспы, пульс менее 100 уд./мин, кожные покровы очень бледные (белая асфиксия), мышцы атоничны, реакция на назофарингеальный катетер отсутствует, симптом «белого пятна» более 3 с, артериальная гипотония.
Общее состояние оценивается как тяжелое или крайне тяжелое.
В первые часы и дни жизни клиническая картина обусловлена полиорганной недостаточностью. Со стороны центральной нервной системы: гипоксически-ишемическая энцефалопатия, отек мозга, внутричерепные кровоизлияния, судороги.
Со стороны легких: синдром аспирации меконием, легочная гипертензия, синдром дыхательных расстройств II типа.
Со стороны сердечно-сосудистой системы: шок, гипотензия, полицитемия, гиперволемия или гиповолемия, патологическое шунтирование крови, трикуспидальная недостаточность, ишемические некрозы эндокарда/миокарда.
Со стороны выделительной системы: олигурия, острая почечная недостаточность с тромбозами сосудов почек или без них.
Со стороны желудочно-кишечного тракта: функциональная непроходимость, рвота, срыгивания, печеночные дисфункции, некротизирующий энтероколит.
Со стороны эндокринной системы: транзиторная недостаточность симпато-адреналовой системы, щитовидной железы, надпочечников.
Все это сопровождается нарушениями гомеостаза (декомпенсированный ацидоз, гипогликемия, гипокальциемия, гипоантриемия, гипомагниемия) и гемостаза (тромбоцитопения, ДВС-синдром).
Вторичный иммунодефицит, сопровождающий полиорганную недостаточность, способствует активации и генерализации внутриутробных инфекций, а также развитию госпитальных инфекций.
Диагностика и рекомендуемые клинические исследования
Критериями тяжелой асфиксии являются:
Важными критериями тяжести асфиксии являются ответ на адекватную терапию, а также течение и исход патологии в раннем неонатальном периоде, отражающие выраженность повреждения витальных функций. Следовательно, окончательно тяжесть асфиксии диагностируют не сразу после родов, а по окончании раннего неонатального периода.
Необходимый объем исследований:
В оптимальном варианте — допплерографическое определение центральной и церебральной гемодинамики.
С учетом необходимости проведения дифференциального диагноза с тяжелыми инфекционными заболеваниями показано микробиологическое, вирусологическое исследование.
Дифференциальный диагноз в первую очередь необходимо проводить со следующими состояниями:
Общие принципы лечения
Проведение реанимационных мероприятий при асфиксии новорожденных регламентируется приказом министра здравоохранения и медицинской промышленности РФ «Первичная и реанимационная помощь новорожденному в родильном зале» (1995 г.).
При оказании реанимационной помощи новорожденному необходимо строго соблюдать следующую последовательность действий:
Лекарственные средства (ЛС) при первичной реанимации назначаются при отсутствии сердцебиения и в тех случаях, когда несмотря на искусственную вентиляцию легких (ИВЛ) 100% кислородом и непрямой массаж сердца, проведенные в течение 30 с, у ребенка сохраняется брадикардия ниже 80 уд./мин.
Используются следующие ЛС: раствор адреналина гидрохлорида, препараты, восполняющие объем циркулирующей жидкости (раствор альбумина 5%, изотонический раствор натрия хлорида, раствор рингера), раствор гидрокарбоната натрия 4%.
Адреналина гидрохлорид является синтетическим аналогом адреналина надпочечников. Обладает адренопозитивным действием, оказывая стимулирующее влияние на α- и β-адренорецепторы. Инотропное кардиотоническое действие адреналина связано с воздействием на β1-адренорецепторы, локализующиеся в миокарде. Это ведет к повышению силы и частоты сердечных сокращений. Наряду с этим адреналин, воздействуя на α-адренорецепторы, повышает периферическое сосудистое сопротивление и артериальное давление крови, тем самым увеличивая коронарный кровоток и кровоснабжение миокарда.
Бронхорасширяющее действие адреналина обусловлено воздействием на β2-адренорецепторы.
Адреналин вводится новорожденным в разведении 1:10 000 в объеме 0,1–0,3 мл/кг массы тела (0,01–0,03 мг/кг) внутривенно или эндотрахеально. При введении через эндотрахеальную трубку требуется дополнительное разведение физиологическим раствором (1:1). Внутривенно адреналин вводится струйно.
В результате должно наблюдаться увеличение частоты сердечных сокращений до 100 уд./мин и выше через 30 с после введения ЛС. Если частота сердечных сокращений остается менее 100 уд./мин, следует повторить введение адреналина. При отсутствии эффекта и признаков общей кровопотери или гиповолемии необходимо ввести восполнители объема циркулирующей крови.
Показаниями к восполнению объема циркулирующей крови служат кровопотеря и гиповолемия. При этом наблюдаются следующие симптомы:
Восполнители объема циркулирующей крови (изотонический раствор натрия хлорида, раствор альбумина 5%, раствор рингера) вводятся новорожденным при первичной реанимации в вену пуповины из расчета 10 мл/кг массы тела в течение 5–10 мин.
Показания к применению гидрокарбоната натрия:
Используется 4% раствор гидрокарбоната натрия, содержащий 0,5 мэкв/мл. Назначается в дозе 2 мэкв (4 мл 4% раствора) на кг массы тела. Вводится в вену пуповины на фоне ИВЛ со скоростью не выше 1 мэкв /кг/мин.
Ожидаемый эффект: увеличение частоты сердечных сокращений до 100 и более ударов в минуту на фоне уменьшения метаболического ацидоза.
Положительный эффект от реанимационных мероприятий — в течение первых 20 мин после рождения восстанавливаются адекватное дыхание, нормальные частота сердечных сокращений и цвет кожных покровов — служит основанием к прекращению ИВЛ и непрямого массажа сердца. Однако реанимация в родильном зале является лишь первым этапом оказания помощи детям, родившимся c асфиксией.
Дальнейшее наблюдение и лечение новорожденных, перенесших асфиксию, в том числе и детей, у которых не восстановилось адекватное дыхание, наблюдаются судороги, центральный цианоз, проводится в отделении интенсивной терапии.
При внутривенном введении раствора гидрокарбоната натрия на фоне неадекватной вентиляции возможно усиление ацидоза, а избыточное введение этого ЛС ведет к гипернатриемии и риску развития внутрижелудочковых кровоизлияний.
Эффективная сердечно-легочная реанимация при асфиксии является главным фактором, улучшающим прогноз. При средней и умеренной асфиксии прогноз, как правило, благоприятный. При тяжелой асфиксии персистирующая низкая оценка по шкале Апгар (0–3 балла) на 10, 15 и 20-й минутах достаточно тесно коррелирует с неблагоприятным исходом и указывает на повышенный риск смерти (60% — у доношенных новорожденных и 50–100 % — у детей с очень малой массой тела).
Литература
А. Г. Антонов, доктор медицинских наук, профессор
НЦАГиП РАМН, Москва
Гипоксия и асфиксия у новорожденных
Одной из самых сложных и травмирующих ситуаций в жизни ребенка являются роды, даже при самом физиологическом их течении. Этот процесс требует значимой перестройки, как со стороны организма матери, так и со стороны младенца.
Если в процессе внутриутробной жизни, во время родов или в ранний период после рождения ребенок испытывает кислородное голодание – такое состояние называется гипоксией. Гипоксические повреждения возникают вследствие кислородного голодания тканей.
В зависимости от длительности течения гипоксия может быть хронической – от нескольких суток до нескольких месяцев (характерно для внутриутробной гипоксии плода) и острой – от нескольких минут до нескольких часов, возникающей при быстрых нарушениях поступления кислорода в организм (чаще при интранатальной гипоксии).
Кислородную недостаточность у родившегося ребенка называют асфиксией.
Причиной асфиксии могут быть факторы со стороны ребенка, матери, а также маточно-плацентарные. Материнские причины – это её состояние здоровья, возраст, другие социально-демографические аспекты. Имеет значение степень и динамика наблюдения за беременной женщиной, а также оценка маточно-плацентарного кровотока – фактора, помогающего минимизировать неблагоприятный фон развития острой ситуации.
Нарушения и последствия вызываемые гипоксией (асфиксией)
В зависимости от тяжести и длительности воздействия кислородная недостаточность может оказать как минимальное влияние, так и исказить всё последующее развитие ребенка. Важно, что сразу после воздействия гипоксии на мозг объём поражения может быть одним, а впоследствии может увеличиваться. Поэтому в первые дни жизни ребенка, перенесшего гипоксию или асфиксию, не всегда можно надежно спрогнозировать исход.
Доношенный ребенок биологически и генетически запрограммирован на успех без тяжелой структурной патологии, ему легче справится с острой ситуацией, возникшей в родах. У недоношенного ребенка асфиксия накладывается на структурно незрелые органы и ткани. Поэтому, степень зрелости ребенка определяет патологические изменения, которые проявляются с течением жизни.
У детей с тяжелой асфиксией речь идет о борьбе за выживаемость, а у детей с перенесенной гипоксией речь идет об улучшении качества жизни и социальной адаптации.
Как уменьшить последствия гипоксии для ребенка
Оценка интеллектуального, речевого, моторного, социально-эмоционального развития ребенка, его адаптивное поведение должно оцениваться врачами различных специальностей: неврологами, педиатрами, остеопатами, логопедами, психологами и т.д.
Врач-остеопат и неонатолог оценивают функцию различных систем организма как целостной системы, улучшая кровоснабжение, движение спинномозговой жидкости, иннервацию, подвижность тканей.
Остеопаты создают благоприятные условия для реорганизации поврежденных структур нервной системы, так как существует прямая взаимосвязь двигательной активности, языка и интеллектуальных способностей. Особенно важно систематическое наблюдение у врача-остеопата за ребенком при формировании новых навыков в процессе его роста.
Поэтому, чем раньше начать реабилитацию маленьких пациентов, тем выше шанс уменьшить последствия гипоксии.
Чем дышит новорожденный ребенок
Мамочки грудничков часто прислушиваются к их дыханию. Что же надо знать о том, как дышит новорожденный?
Трудная наука
Целых 40 недель семья с радостью и нетерпением ожидала рождения малыша. В животике у мамы он полностью зависел от нее. Вместе с ней гулял по лесу или парку, получал достаточное (либо недостаточное) количество кислорода.
Тренироваться дышать кроха начинает уже на последнем месяце внутриутробной жизни, когда совершает около полусотни дыхательных движений в минуту, облегчая поступление крови к сердцу. Он делает вдохи с сомкнутой голосовой щелью, чтобы не захлебнуться в околоплодных водах.
После рождения происходит ряд важных изменений: прекращается поступление питательных веществ и кислорода через плаценту. А с первым криком новорожденного расправляются легкие, и ребенок начинает самостоятельно дышать. Кровообращение и обмен веществ также работают теперь по-новому.
Обмен веществ у ребенка происходит гораздо быстрее, чем у взрослого, и он больше, чем у взрослого, и он больше, чем взрослый, нуждается в кислороде. Повышенная потребность в нем компенсируется более частым дыханием.
Новорожденные дышат неритмично, временами их дыхание становится слабым, едва слышным. Они дышат животом.
В первые трое суток жизни через легкие новорожденного «прокачивается» воздуха вдвое больше, чем у ребенка старшего возраста.
Кроха делает глубокий вдох с затрудненным выдохом, что препятствует спасению и слипанию мельчайших легочных камер (альвеол) и помогает малышу расправить легкие, а всей дыхательной системе – создать высокое сопротивление выдыхаемому воздуху для первого вдоха и первого крика маленького существа.
В случаях удушья, или асфиксии, еще совсем недавно кроме шлепания по попке малыша «взбадривали» окунанием в холодную воду. Сегодня этим методом уже не пользуются. Сначала рефлексы активизируют поглаживанием по спинке или похлопыванием по пяткам. Если малышу по-прежнему плохо, то переходят к действенной реанимации.
Рождение для малыша с его пока несовершенной дыхательной системой – трудный экзамен. Легкие грудного ребенка развиты слабо, их эластичная ткань хорошо наполняется кровью, но недостаточно – воздухом.
Из-за плохой вентиляции у маленьких детей часто наблюдается «спадение» легочной ткани. В первые месяцы жизни постепенно меняется структура
легких: соединительно-тканые прослойки заменяются эластичной тканью, увеличивается количество альвеол. Подвижность грудной клетки у грудничков ограничена, и сначала легкие растут за счет мягкой диафрагмы. Тип дыхания у крохи меняется на диафрагмальный, или брюшной. Грудным или грудобрюшным оно становится только после того, как дети начинают ходить.
К 6 месяцам дыхание становится реже – 35-40 вдохов-выдохов в минуту, а к году ребенок уже дышит с частотой 30 раз в минуту. У взрослого человека частота дыхания в норме не превышает 18 вдохов в минуту.
Врожденные рефлексы
Нет ни одной мамы, которая время от времени не прислушивалась бы: дышит ли малыш?
Особенно волноваться не стоит. Помните, что уже с самого рождения малыш обладает набором врожденных рефлексов. Если положить кроху на живот, он автоматически повернет голову набок, чтобы иметь возможность дышать. Кашель и чихание тоже относятся к таким врожденным рефлексам.
Периодические паузы в дыхание – наследие внутриутробной жизни. Даже у совершенно здоровых малышей наблюдаются короткие паузы в дыхании, но продолжительность этих перерывов никак не может превышать 12-15 секунд.
Педиатры рекомендуют относиться к нерегулярности детского дыхания с большим вниманием, так как из-за временного кислородного голодания головного мозга апноэ может представлять угрозу.
Ненавязчивый контроль за дыханием необходим не только незрелому ребенку, но и совершенно здоровому, доношенному малышу от 3 до 8 месяцев.
Чтобы ребенок «помнил», что ему необходимо дышать ритмично, без остановок, он нуждается в почти непрерывной тактильной стимуляции. Почаще ласкайте кроху, берите его на ручки, прижимайте к себе. Примерно после 8 месяца жизни регулярность дыхания у ребенка наладится, но до той поры ему необходим контакт кожа к коже.
Когда специалисты считают, что случай у вашего малыша особый и ему нужен постоянный контроль за дыханием, можно воспользоваться различными моделями дыхательных мониторов. Принцип их действия таков, если у крошки во время сна или бодрствования возникнут перебои с дыханием, частота его станет менее 10 дыхательных движений в минуту, или же остановка дыхания продолжится долее 12 секунд, раздастся громкий звуковой сигнал и загорится красный индикатор тревоги. Это сообщение о том, что ваш малыш нуждается в экстренных мерах для восстановления нормального дыхания.
Вы его не задавите!
Некоторые мамы боятся задавить кроху во сне. Но подумайте сами: вы кормите ребеночка, лежа в удобной позе, становясь в этот момент как бы единым целым. И тут уж вероятность того, что вы задавите своего кроху, абсолютно исключена. Окружите малыша своим теплом и любовью!
Разрабатываем легкие крохи!
Как создать наилучшие условия для малыша?
Особенности развития органов дыхания.
Частота дыхания у ребенка
Возраст
Количество вдохов-выдохов (в минуту)
СТРИДОР у новорожденных и детей первого года жизни
Стридор — это грубый различного тона звук, вызванный турбулентным воздушным потоком при прохождении через суженный участок дыхательных путей [36].
Стридор — это грубый различного тона звук, вызванный турбулентным воздушным потоком при прохождении через суженный участок дыхательных путей [36]. Стридор у новорожденных и грудных детей — это патология, которая является симптомом дыхательной обструкции [7]. Стридор может быть симптомом угрожающих жизни заболеваний. Наиболее важными характеристиками стридора являются его громкость, высота и фаза дыхания, на которой он появляется.
Громкий стридор обычно является симптомом выраженного сужения дыхательных путей. В случае прогрессивно усиливающегося стридора внезапно ослабевший звук может быть признаком усилившейся обструкции, ослабления дыхательных движений и возникновения коллапса дыхательных путей [28].
Высоко звучащий стридор обычно вызван обструкцией на уровне голосовых складок [26], низко — патологией выше голосовых складок (гортанная часть глотки, верхний отдел гортани). Стридор средней высоты чаще является симптомом обструкции ниже голосовых складок [41].
Наиболее важным признаком, позволяющим заподозрить уровень поражения, является фаза дыхания, на которой стридор слышен лучше всего. По этому признаку стридор может быть разделен на три типа: инспираторный, экспираторный и двухфазный. Инспираторный стридор обычно вызывается поражением, локализующимся выше голосовых складок, и продуцируется коллапсом мягких тканей при отрицательном давлении во время вдоха [22]. Двухфазный стридор обычно высокий по тону. Он вызван поражением на уровне голосовых складок или подскладкового отдела [16, 18]. Экспираторный стридор чаще возникает при поражении нижних отделов дыхательных путей [42].
Анамнез очень важен для диагностики заболевания. Ключевыми анамнестическими данными являются причины и длительность интубации (если она ранее производилась) в неонатальный период. Другие анамнестические признаки включают возраст на момент появления стридора, длительность стридора, ассоциацию с плачем или кормлением, с положением ребенка; наличие других сопутствующих симптомов, таких как пароксизмы кашля, аспирация или срыгивание [40, 41].
При осмотре ребенка следует оценить его общее состояние, частоту дыхательных движений и сердечных сокращений, цвет кожи. Кроме того, следует обратить внимание на возможные аномалии строения головы, участие дополнительных мышц в акте дыхания, втяжение уступчивых мест грудной клетки и другие признаки, исключить возможное инфекционное заболевание [36].
При состоянии ребенка, не требующем немедленного вмешательства, следует произвести рентгенографию гортани и мягких тканей шеи в передней и боковой проекции, грудной клетки, а также рентгеноскопию пищевода с водорастворимым рентгеноконтрастным веществом. Кроме того, могут быть полезны ультразвуковое исследование гортани, компьютерная томография, ядерно-магнитный резонанс [12, 30].
Наиболее информативным методом диагностики заболевания, проявляющегося врожденным стридором, является эндоскопическое исследование: фиброскопия; прямая ларингоскопия под наркозом, желательно — с использованием микроскопа; трахеобронхо- и эзофагоскопия [11, 36]. При этом необходимо учитывать возможность аномального строения нескольких отделов дыхательных путей [23, 25].
 |
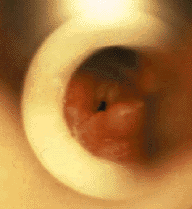
| Рисунок 1. Эндофотография гортани. Мягкий, западающий в просвет дыхательных путей надгортанник |
Ларингомаляция — наиболее распространенная причина стридора [16, 30]. Анатомически можно выделить следующие формы ларингомаляции: за счет западания в просвет гортани мягкого надгортанника (рис. 1); за счет черпаловидных хрящей, при вдохе подтягивающихся кверху или подтянутых кверху изначально, за счет укороченной черпалонадгортанной складки (рис. 2); смешанная форма, когда в просвет дыхательных путей западают и надгортанник, и черпаловидные хрящи. Ларингомаляция обычно протекает
 |
| Рисунок 2. Эндофотография гортани. Западающие в просвет гортани черпаловидные хрящи |
«доброкачественно» и самопроизвольно исчезает, обычно к 1,5 — 2 годам жизни. Мальчики страдают в два раза чаще девочек. Стридор обычно появляется с рождения, но в некоторых случаях возникает только со второго месяца жизни. Симптомы могут быть преходящими и усиливаться при положении ребенка на спине или во время крика и возбуждения. Тяжесть заболевания может быть различной. У большинства детей отмечается только шумное, звучное дыхание, но в ряде случаев ларингомаляция вызывает явления стеноза гортани, требующие интубации и даже трахеотомии. В тяжелых случаях прибегают к оперативному лечению, обычно при помощи лазера — к нанесению надрезов на надгортаннике, рассечению черпалонадгортанных складок или удалению части черпаловидных хрящей.
Паралич голосовых складок — вторая по частоте причина врожденного стридора [39, 41]. Обычно его обнаруживают у детей с другими врожденными аномалиями или с поражением ЦНС [29]. Часто причина паралича остается невыясненной, и такой вид паралича считается идиопатическим. В случае идиопатического паралича (возможной причиной которого является родовая травма) часто
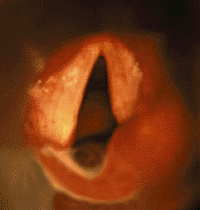 |
| Рисунок 3. Эндофотография гортани. Паралич правой черпаловидной складки |
возникает спонтанное излечение. В других случаях причиной могут быть кровоизлияния в желудочки мозга, менингоэнцефалоцеле, гидроцефалия, перинатальная энцефалопатия и другие заболевания [29]. Кроме того, можно выделить ятрогению (например, при повреждении возвратного гортанного нерва) как причину развития паралича голосовых складок.
Двусторонний паралич вызывает высокотональный стридор и афонию. Около половины детей с двусторонним параличем нуждаются в трахеотомии [22, 26, 39].
При одностороннем параличе (рис. 3) обычно отмечают слабый крик, голос с возрастом постепенно улучшается. Дыхательная функция при одностороннем параличе обычно не страдает [28].
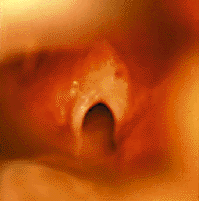 |
| Рисунок 4. Эндофотография гортани. Врожденная рубцовая мембрана гортани |
Врожденные рубцовая мембрана (рис. 4) и подскладковый стеноз развиваются в результате неполного разделения зародышевой мезенхимы между двумя стенками формирующейся гортани [33]. Значительно чаще обнаруживают приобретенные рубцовые стенозы (рис. 5), обычно развивающиеся в результате продленной чрезгортанной назотрахеальной интубации. Тяжесть заболевания зависит от степени поражения: небольшая рубцовая мембрана, локализующаяся только в области передней комиссуры, клинически проявляется лишь изменением голоса («петушиный крик»); полная атрезия гортани совместима с жизнью только теоретически [30].
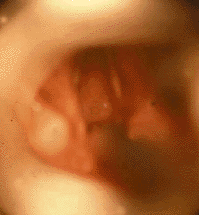 |
| Рисунок 5. Эндофотография гортани. Приобретенный подскладковый стеноз (точечный просвет дыхательных путей) |
Ведущими клиническими симптомами заболевания являются явления обструкции верхних дыхательных путей, такие как двухфазный стридор, тахипноэ, цианоз, беспокойство, раздувание крыльев носа при дыхании, участие в акте дыхания вспомогательной мускулатуры и др. При локализации мембраны в области голосовых складок отмечаются нарушения голоса вплоть до афонии.
Ведущий метод диагностики — эндоскопия [30], хотя косвенно помогает рентгенография гортани и трахеи в передней и боковой проекции.
 |
| Рисунок 6. Эндофотография гортани. Киста язычной поверхности надгортанника |
Лечение обусловлено выраженностью симптомов. Только дети с небольшой переднекомиссуральной синехией могут быть оставлены под наблюдением без оперативного лечения; больные с мембраной средних размеров, вызывающей нарушение дыхания, требуют оперативного лечения (чаще — лазерная деструкция) в период новорожденности. Дети с выраженной мембраной обычно нуждаются в трахеотомии в период новорожденности с последующей операцией (при помощи лазера или наружным доступом) в более старшем возрасте [17, 38].
 |
| Рисунок 7. Эндофотография гортани. Киста правой голосовой складки |
В ряде случаев врожденный подскладковый стеноз сопровождается другими врожденными поражениями [34]. При выборе тактики лечения необходимо учитывать, что дыхание может улучшаться с ростом гортани.
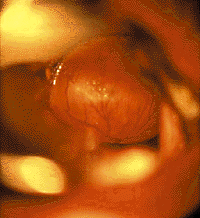
Кисты гортани. Стридор возникает при росте кисты в просвет дыхательных путей или сдавлении мягких тканей гортани. Кроме того, при локализации на гортанной и особенно на язычной поверхности надгортанника (рис. 6) они могут вызывать дисфагические явления [20, 30].
Локализация кист может быть разнообразной — надгортанник, надскладковая область, черпалонадгортанные складки, подскладковый отдел. Часто кисты развиваются у детей с интубацией в анамнезе, и в таких случаях могут быть множественными. Небольшие кисты голосовых складок (рис. 7) клинически проявляются только охриплостью. При зеркальной ларингоскопии, особенно если подслизистая киста локализуется на границе передней и средней трети голосовой складки, ее ошибочно диагностируют как «певческий» узелок. В этом случае правильный диагноз можно установить только при осмотре гортани под наркозом с применением оптики.
 |
| Рисунок 8. Эндофотография гортани. Подскладковая гемангиома под левой голосовой складкой |
Для лечения используют аспирацию содержимого кисты с последующим иссечением ее стенок микроинструментами или СО2-лазером [6, 8, 30].
Кисты часто рецидивируют. В некоторых случаях требуются операции наружным доступом для иссечения больших множественных рецидивирующих кист [31].
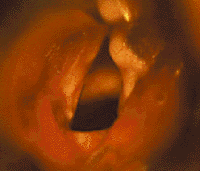
Подскладковая гемангиома (рис. 8) угрожает жизни ребенка. По данным зарубежной литературы, средняя летальность от этого заболевания составляет 8,5% [43]. В большинстве случаев подскладковая гемангиома имеется с рождения и подвергается росту в течение первых месяцев жизни. Стридор обычно появляется на 2-3 месяце жизни, первые симптомы заболевания обычно ошибочно диагностируют как круп [27]. В трех наших наблюдениях дыхательный стеноз развился в первые сутки после криодеструкции гемангиом кожи. Стридор обычно двухфазный, голос может быть не изменен. Более половины детей имеют гемангиомы кожи. Как и при гемангиомах кожи, девочки страдают втрое чаще мальчиков [9]. Тяжесть заболевания зависит от размера гемангиомы, в случае присоединения ОРВИ или при беспокойстве дыхание может ухудшаться.
Ведущий метод диагностики — эндоскопия. Обычно обнаруживают мягкотканное выбухание розового или красного цвета под голосовой складкой (чаще — под левой) [5]. Если ребенок был ранее интубирован в связи с дыхательным стенозом, гемангиома может быть не диагностирована при осмотре дыхательных путей сразу после экстубации.
Для лечения используется СО2-лазерная деструкция гемангиомы с последующей гормональной терапией [6, 24]. В случае прорастания в гортань гемангиомы передней поверхности шеи необходима трахеотомия с последующей близкофокусной рентгенотерапией или лечением кортикостероидами [2].
 |
| Рисунок 9. Эндофотография гортани. Ювенильный респираторный папилломатоз |
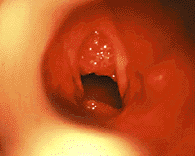
Ювенильный респираторный папилломатоз (ЮРП) (рис. 9) — наиболее часто встречающаяся опухоль верхних дыхательных путей у детей. Этиологическим фактором папилломатоза является вирус папилломы человека, чаще — 6 и 11 типа [3]. Хотя у подавляющего большинства больных первые симптомы заболевания развиваются на 2 — 3 году жизни, в ряде случаев можно говорить о врожденном папилломатозе гортани, когда первые симптомы заболевания отмечают с момента рождения [1].
Начальным симптомом заболевания обычно является охриплость, постепенно переходящая в афонию. В дальнейшем, по мере роста папиллом и сужения просвета голосовой щели (обтурирующая форма), возникает прогрессирующий стеноз гортани, проявляющийся как инспираторный или двухфазный стридор [10].
Наиболее частой первичной локализацией папиллом гортани является область комиссуры и передней трети голосовых складок. На более поздних этапах заболевания папилломы могут поражать все отделы гортани, а также выходить за ее пределы. Папилломы обычно имеют широкое основание, однако возможен рост конгломератов папиллом на небольшой ножке. По внешнему виду папилломы напоминают тутовую ягоду или кисть винограда. При микроларингоскопии поверхность папиллом обычно неровная мелкозернистая или мелкодольчатая, цвет — чаще бледно-розовый, иногда с сероватым оттенком. Тяжесть заболевания определяется скоростью роста папиллом и частотой рецидивирования [15].
Основным методом ликвидации стеноза у детей с ЮРП является хирургическое удаление папиллом при помощи микроинструментов и/или СО2-лазера. Однако только хирургическое лечение у большинства больных не предотвращает рецидива заболевания. В настоящее время наиболее патогенетически оправданным и перспективным является длительное непрерывное введение препаратов интерферона [13, 19, 21].
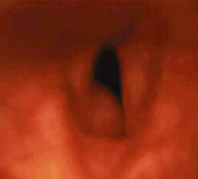
Трахеомаляция. Различают диффузную и локальную формы трахеомаляции, т. е. слабости стенки трахеи, связанной с патологической мягкостью ее хрящевого каркаса. Клинически заболевание проявляется экспираторным стридором. При эндоскопии обнаруживают резкое сужение на выдохе просвета трахеи, которая может принимать различную форму. Симптомы заболевания часто спонтанно исчезают на 2 — 3 году жизни [32]. При выраженных дыхательных нарушениях может потребоваться трахеотомия [41].
 |
| Рисунок 10. Эндофотография трахеи. Врожденный рубцовый стеноз |
Врожденный стеноз трахеи (рис. 10) может иметь различную природу. Органические стенозы связаны с локальным дефектом хрящевых полуколец трахеи (недостаток или отсутствие хряща) или избыточным образованием хрящевой ткани, приводящим к формированию твердого хрящевого выпячивания в просвет трахеи [42].
Функциональные стенозы связаны с чрезмерной мягкостью хрящей и в этом случае являются локальной формой трахеомаляции. Экспираторный стридор обнаруживают обычно сразу после рождения. Стридор усиливается при беспокойстве или кормлении ребенка. Состояние больного обычно резко ухудшается во время ОРВИ, в некоторых случаях отмечают приступы удушья, ошибочно диагностируемые как круп. Для исключения сдавливания трахеи извне необходимо рентгеноконтрастное исследование пищевода. Основной способ диагностики — эндоскопический. Стенозы трахеи, особенно на почве трахеомаляции, имеют благоприятный прогноз, в большинстве случаев спонтанно излечиваются.
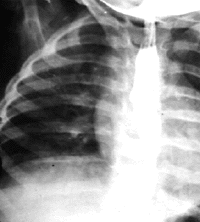 |
| Рисунок 11. Рентгенограмма органов грудной клетки. Сдавление пищевода аномально расположенным сосудом |
Сосудистое кольцо. Аномальная конфигурация больших сосудов может вызывать сдавление трахеи, обычно ее дистальных отделов. Кроме того, может сдавливаться также пищевод. Стридор усиливается при плаче или кормлении, а также при положении ребенка на спине. Часто отмечается срыгивание. Диагноз устанавливают при помощи рентгенографии пищевода с рентгеноконтрастным препаратом (рис. 11) и аортографии. Чаще всего встречается удвоение дуги аорты, добавочная левая легочная артерия [14, 37].
При эндоскопии можно обнаружить выбухание и, в ряде случаев, пульсацию передней стенки трахеи. Лечение — хирургическое.
Ларинготрахеопищеводная щель — редкий врожденный дефект развития. На большом протяжении дыхательные пути сообщаются с пищеводом. Причиной этого порока является незаращение дорсальной части перстневидного хряща. Это заболевание клинически проявляется средней громкости двухфазным стридором и эпизодами аспирации. У детей с этим пороком часто отмечают повторные пневмонии. Типичными являются пароксизмы кашля и цианоз. Голос тихий. Приблизительно у 20% детей имеется также трахеопищеводная фистула с характерной локализацией в дистальном отделе трахеи [35]. Для установления диагноза, кроме эндоскопии, требуется рентгеноскопия органов грудной клетки с контрастом. Для лечения необходима не только трахеотомия, но и наложение гастростомы для кормления ребенка.
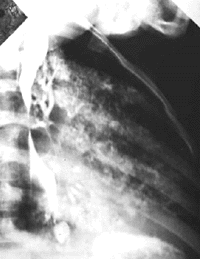 |
| Рисунок 12. Рентгенограмма органов грудной клетки. Затекание рентгеноконтрастного вещества через трахеопищеводный свищ из пищевода в трахеобронхиальное дерево |
Трахеопищеводный свищ (рис. 12) проявляется при первом же кормлении ребенка тяжелыми приступами удушья, кашля и цианоза [41]. В основе порока лежит неполное развитие трахеопищеводной стенки. Часто этот порок сочетается с атрезией пищевода. В дальнейшем быстро присоединяется тяжелая аспирационная пневмония. Лечение только хирургическое, результаты часто зависят от срока операции. Прогноз тем более благоприятен, чем раньше предпринято вмешательство.
Учитывая то, что пороки развития гортани и трахеи являются проявлением эмбриопатий, у больных с врожденной патологией этих органов весьма вероятны проявления эмбриопатий со стороны других органов и систем. В клинической практике наибольшую сложность для установления нозологической формы заболевания представляют его синдромальные формы. В основу синдромального метода обследования положено то обстоятельство, что большинство дефектов развития могут быть изолированными или входить в состав известных синдромов или неуточненных комплексов множественных врожденных дефектов. Установление синдромологического диагноза влияет на следующие факторы: 1) проведение тщательной диагностики скрытых дефектов развития и функциональных отклонений в рамках установленного синдрома; 2) выполнение специфической предоперационной подготовки больного для предупреждения возможных осложнений во время хирургического вмешательства или в послеоперационном периоде; 3) тактику и результаты лечения, что выражается в ряде случаев в отказе от хирургических вмешательств, в том числе в изменении хирургической техники коррекции некоторых дефектов развития.
По нашим данным, синдромологический диагноз может быть установлен приблизительно у 25% больных [4]. Лишь у 8-10% детей врожденная патология гортани и трахеи имеет изолированную форму. Остальные больные с врожденными заболеваниями гортани и трахеи имеют иные пороки развития — центральной нервной, костно-мышечной, сердечно-сосудистой систем, аномалии развития ушных раковин, пороки развития лица, аномалии соединительной ткани, врожденные опухолевидные образования кожи и др. Сочетание пороков развития органов нескольких систем, не индуцируемых друг другом, у этой группы больных можно расценивать как множественные неуточненные врожденные пороки развития.


