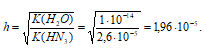чем дезактивировать азотистоводородную кислоту
Чем дезактивировать азотистоводородную кислоту
Азиды можно разделить на 2 основные группы: неорганические и органические азиды. Неорганические азиды включают следующие материалы.
1. Нормальный азид — азид натрия (NaN3), азид калия (KN3), азид бария (Ba[N3])2 и азид свинца (Pb[N3]2).
2. Смешанные азиды — галогениды азида, основные азиды (никельгидроксидазид ([OH]N,[N3]).
3. Гетероазиды —- цианогеназид.
4. Азидокомплекс.
5. Металлорганические азиды — триэтилсвинецазид.
В число органических азидов входят этилазиды, амила-зиды, азид-сАМФ, азидо-НАД+ и др.
Риск для здоровья. В результате контакта как неорганических, так и органических азидов с концентрированной серной кислотой образуется азотистоводородная кислота, которая может быть летучей, токсичной и взрывоопасной.
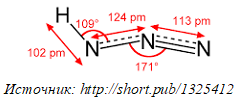
Азотистоводородная кислота (азоимид), HN3 (CAS 7782-79-8) — это кислота, примерно аналогичная уксусной по силе. В связи со слабой степенью диссоциации и летучести азотистоводородная кислота высвобождается из водных растворов кислоты или ее солей. Она обладает значительной взрывной мощностью. В Германии ПДК для нее составляет 0,1 ppm (0,27 мг/м3). Она кипит при 37 °С (нормальная температура человеческого тела), выделяя бесцветный газ с резким запахом.
Клиника отравления азотистоводородной кислотой. У рабочих, подвергшихся воздействию паров азотистоводородной кислоты, может произойти быстрое и очень сильное падение как систолического, так и диастолического кровяного давления, сопровождающееся головными болями. Продолжительная (от 1 до 15 лет) экспозиция рабочих к азотистоводородной кислоте в концентрациях от 0,3 до 3,9 ppm не вызывала каких-либо ощутимых патологических изменений.
У 23-летнего химика, случайно вдохнувшего пары азотистоводородной кислоты, развились конъюнктивит, бронхит, отек обоих колен, лихорадка и голубоватое окрашивание ног. Он выжил. Намеренное вдыхание 1 % раствора привело к снижению кровяного давления с 125/100 мм рт.ст. до 70/50 мм рт.ст., коллапсу, нормализации состояния через 15 мин. В течение примерно получаса наблюдались остаточные головные боли, а затем наступило полное выздоровление.
Когда для определения содержания серы в нефтепродуктах использовали азид натрия, экспозиция персонала лаборатории к такой низкой концентрации азотистоводородной кислоты, как 0,5 ррт, обусловила головные боли и затрудненное носовое дыхание.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Форум химиков
Нужно мнение эксперта.
Нужно мнение эксперта.
Сообщение 5tak000 » Вт ноя 10, 2009 12:34 pm
Возможно обращаюсь немножко не по адресу, но тем не менее. В химии я полный ноль, поэтому хотелось бы услышать мнение специалиста по поводу следующего.
Вот такой вот интерестный коментарий нашел в сети к посту о Гриппе:
Возможно ли то о чем человек написал в своем коментарие, и ели да приведите больше подробностей.
К администрации: если я часом не в тот раздел форума написал, перенесите в соответствующий, что побольше народу могло ознакомиться. Зарание спасибо.
Мой Дополнительный и-меил : piatak000@yandex.ru
Re: Нужно мнение эксперта.
Сообщение Шуша » Вт ноя 10, 2009 12:47 pm
Re: Нужно мнение эксперта.
Сообщение varban » Вт ноя 10, 2009 1:18 pm
У нас на заре демократии заподозрили пасту Виксинт У-2-28 на радиоактивность.
Как же, 228 U, на емкостях написано: U-2-28.
И отдали в Академии наук на определение радиоактивности.
Что характерно, результату не поверили.
А мы все красная ртуть, красная ртуть.
Тут розовый уран, а все молчат!
Re: Нужно мнение эксперта.
Сообщение 5tak000 » Вт ноя 10, 2009 1:36 pm
Re: Нужно мнение эксперта.
Сообщение SkydiVAR » Вт ноя 10, 2009 2:19 pm
Re: Нужно мнение эксперта.
Сообщение Pikril » Вт ноя 10, 2009 3:38 pm
Re: Нужно мнение эксперта.
Сообщение Maryna » Вт ноя 10, 2009 4:29 pm
Re: Нужно мнение эксперта.
Сообщение Любитель_Манниха » Вт ноя 10, 2009 6:08 pm
Re: Нужно мнение эксперта.
Сообщение Polychemist » Вт ноя 10, 2009 6:22 pm
Re: Нужно мнение эксперта.
Сообщение 5tak000 » Вт ноя 10, 2009 7:00 pm
Огромное спасибо, господа. Понял что это нереально. Этого я и хотел. Просто часто бывает так:
Начитаютсяв инете всякой ерунды и давай обсуждать вдоль и поперек, неразбираясь в данной теме.
Вот чтоб этого небыло, собственно и задаю тут всякие дурацкие вопросы.
Будем щитать тему закрытой
П.С. орфография плохая потомучти я с Украины и не застал тех времен когда русский в школьную программу входил
Re: Нужно мнение эксперта.
Сообщение mendel » Вт ноя 10, 2009 7:02 pm
Re: Нужно мнение эксперта.
Сообщение Hedgehog » Вт ноя 10, 2009 7:42 pm
Характеристика химических свойств азидоводорода (азотистоводородной кислоты) и его солей
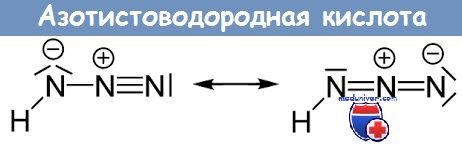
В водном растворе он диссоциирует на ионы Н + и N3 — :
Соли азидоводорода хорошо растворимы в воде, например, азиды щелочных металлов. Сама азотистоводородная кислота и её соли (кроме солей щелочных и щелочно-земельных металлов) являются сильными взрывчатыми веществами.
Азидоводород HN3 получают действием ортофосфорной кислоты на азид натрия NaN3, который синтезируют из амида натрия:
Азидоводород можно получить из гидразина и азотистой кислоты:
Действием серной кислоты на азиды металлов:
Химические свойства азидоводорода
1) Как кислота азидоводород вступает в реакцию нейтрализации с основаниями:
2) Как окислитель азидоводород вступает в реакции окисления-восстановления:
3) Азидоводород как восстановитель:
Восстановительные свойства азидоводорода в растворе обусловлены легкостью превращения его в молекулярный азот:
Азидоводород нельзя получить непосредственно из азота и водорода, так как азот и водород реагируют друг с другом с образованием аммиака.
Азидоводород в данной реакции проявляет окислительную функцию, является восстановителем.
Азидоводород в данной реакции проявляет восстановительную функции, является окислителем.
В данной реакции азидоводород проявляет свойства кислоты.
Задача 893.
Вычислить рН 0,1 н. раствора NaN3 и степень гидролиза соли.
Решение:
NaN3 – соль сильного основания и слабой кислоты гидролизуется по аниону:
Находим рН раствора:
рН = 14 – рОН = 14 – 5,71 = 8,29.
Задача 894.
Закончить уравнения реакций:
Какова функция гидразина в этих реакциях?
Решение:
Азиды щелочных металлов
Азотистоводородная кислота и строение азидной группы. Получение чистого азота и щелочных металлов. Способы синтеза азида натрия. Применение в взрывотехнике, изготовление первичных ВВ (азида свинца). Получение азида натрия из гидразина и его солей.
Кафедра неорганической химии
«Азиды щелочных металлов»
Открытые около ста с лишним лет назад, азиды сыграли важную роль в истории человечества. Как нестабильные вещества находили применения в качестве взрывчатых веществ, сегодня, когда изучены хорошо изучены механизмы их реакций, азиды являются важными компонентами в химическом производстве.
Целью данной работы служит определение понятия как таковых азидов, азотистоводородной кислоты, их строения, свойств, изучения закономерностей их свойств, основных направлений в применении азидов, и основных методик их синтеза.
Более подробно рассмотрены азиды щелочных металлов.
Азидоводородная кислота и строение азид иона
Азотистоводородная кислоты была впервые получена Курциусом в 1890г. Он предположил, что как их аммиака и азотистой кислоты образуется азот:
так и из гидразина и азотистой кислоты должен получится азоимид:
N2H4 + HNO2 = HN3 + 2pO
В качестве исходного вещества он применил гидразиды кислот RCONHNp, которые при взаимодействии с азотистой кислотой образуют соответствующие азоимиды RCON3, например
C6H5CONHNp + HONO = C6H5CON3 + pO
При омылении щёлочью бензоилазоимид расщепляется с образованием солей бензойной и азотистоводородной кислот:
C6H5CON3 +2NaOH = C6H5COONa + NaN3 + pO
При обработке азида натрия серной кислотой образуется азидоводородная кислота
NaN3 + pSO4 = HN3 + NaHSO4
Подобные документы
Использование солей натрия в Древнем Египте, химические способы добычи натрия. Линии щелочных металлов в видимой части спектра, физические и химические свойства щелочей. Взаимодействие соды с синтетической азотной кислотой и гигроскопичность солей натрия.
реферат [3,6 M], добавлен 04.07.2012
Экспериментальное исследование медленного разложения, инициированного действием слабого постоянного магнитного поля, в кристаллах азида серебра, выращенных в однородном и неоднородном магнитных полях. Свойства азида серебра, их кристаллическая структура.
отчет по практике [1,6 M], добавлен 26.05.2015
Общая характеристика щелочных металлов и их соединений, применение в промышленности. Формы металлов, встречающиеся в природе, и способы их получения. Химические свойства щелочных металлов и их взаимодействие с водой, с кислородом, с другими веществами.
презентация [3,9 M], добавлен 22.09.2015
Метод получения 3,4,5-трифенил-1,2-дифосфациклопентадиенида натрия, основанный на взаимодействии циклопропенильных комплексов никеля с полифосфидами натрия. Использование для синтеза стандартной аппаратуры Шленка. Получение полифосфидов натрия.
реферат [583,3 K], добавлен 30.10.2013
Характеристика щелочных металлов, их биологическая роль, распространение в природе и применение. Химические и физические свойства щелочных металлов. Литий, рубидий и цезий в составе живых организмов. Натрий и калий как необходимые для организма элементы.
курсовая работа [75,4 K], добавлен 27.05.2013
Описание взаимодействия органилсиланолятов щелочных металлов с галогенидами металлов, расщепления силоксановой связи оксидами элементов. Синтезирование поливольфрамфенилсилоксанов в водно-ацетоновой среде путем применения фенилсиликонатов натрия.
курсовая работа [274,7 K], добавлен 16.03.2011
Едкий натр или гидроксид натрия. Химические способы получения гидроксида натрия. Понятие об электролизе и электрохимических процессах. Сырье для получения гидроксида натрия. Электролиз растворов хлористого натрия в ваннах со стальным катодом.
реферат [2,4 M], добавлен 13.03.2007
Способы выделения, очистки и анализа органических веществ. Получение предельных, непредельных и ароматических углеводородов, спиртов, карбоновых кислот. Получение и разложение фенолята натрия. Методы выделения белков. Химические свойства жиров, ферментов.
лабораторная работа [201,8 K], добавлен 24.06.2015
Изучение электрохимического производства хлора, щелочи и гипохлората натрия, которое относится к числу крупнотоннажных электрохимических производств. Особенности электролиза с ртутным катодом. Извлечение ртути из растворов производства хлора и щелочи.
контрольная работа [440,6 K], добавлен 11.10.2010
Основные и амфотерные солеобразующие оксиды. Особенности разложения карбонатов металлов. Получение оксидов щелочных металлов косвенным путём. Амфотерность оксида бериллия. Использование оксида магния при производстве огнеупорных строительных материалов.
презентация [218,3 K], добавлен 07.10.2011
Азотистоводородная кислота
| Азотистоводородная кислота | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Азидоводород, азотистоводородная кислота |
| Химическая формула | HN3 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Отн. молек. масса | 43.03 а. е. м. |
| Молярная масса | 43.03 г/моль |
| Плотность | 1,09 г/см³ |
| Термические свойства | |
| Температура плавления | — 80 °C |
| Температура кипения | 37 °C |
| Химические свойства | |
| pKa | от 4.6 до 4.7 |
| Классификация | |
| Рег. номер CAS | 7782-79-8 |
Азо́тистоводоро́дная кислота́, азоими́д, HN3 — кислота, соединение азота с водородом. Бесцветная, летучая, чрезвычайно взрывоопасная (взрывается при нагреве, ударе или трении) жидкость с резким запахом. Очень токсична. Её хорошо растворимые соли тоже очень ядовиты. Механизм токсичности аналогичен цианидам (блокирование цитохромов).
Содержание
Химические свойства
Разбавленные водные растворы не взрывоопасны, но при стоянии раствор HN3 медленно разлагается до азота и гидроксиламина:
В водном растворе HN3 проявляет свойства слабой кислоты (рKа = 4,59). По силе она близка к уксусной кислоте. Водный раствор HN3 называют азидоводородной кислотой (азотистоводородной кислотой). В растворах азидоводородная кислота диссоциирует на ионы:
Кислота HN3 является окислителем. При взаимодействии с металлами образует соль металла, азот и аммиак:
Соли этой кислоты называются азидами. При ударе или нагревании распадаются со взрывом, на чем основано применение азида свинца Pb(N3)2 в качестве детонатора. Относительно устойчивы ионные азиды щелочных металлов, за исключением LiN3.
Смесь HN3 и соляной кислоты HCl подобно «царской водке» является сильным окислителем из-за образующегося хлора и растворяет золото и платину:
Кислота и ее соли разлагаются при действии сильных окислителей с выделением азота.
В органической химии применяется в реакции Шмидта.
Получение
Азидоводород HN3 получают действием ортофосфорной кислоты на азид натрия NaN3, который синтезируют из амида натрия:

Также азидоводород можно получить:
взаимодействием N2H4 с HNO2 действием разбавленной H2SO4 на азиды металлов.