Чего в природе больше нуклидов или изотопов
Чего в природе больше нуклидов или изотопов
Химическая природа атома задаётся электронным облаком, а его состав зависит только от заряда ядра, то есть от числа Z. Поэтому все атомы одной химической природы имеют одинаковый заряд ядра. Следовательно, химический элемент — это совокупность атомов с заданным значением заряда ядра Z. Именно поэтому число Z было названо атомным номером, так как в таблице Менделеева элементы упорядочены по возрастанию Z.
Если нуклиды отличаются массовым числом A, но имеют один и тот же атомный номер Z, то они имеют одинаковую химическую природу, принадлежат одному и тому же элементу и являются изотопами этого элемента. Чтобы обозначить конкретный изотоп, к химическому символу элемента приписывают слева вверху число A, например:
| Химический элемент водород | ||
| протий | дейтерий | тритий |
| 1 H | 2 H или D | 3 H или T |
| Z=1 | Z=1 | Z=1 |
| N=0 | N=1 | N=2 |
| A=1 | A=2 | A=3 |
Как видно из таблицы, природный водород существует в виде трёх изотопов, причём для дейтерия и трития есть даже собственные химические символы.
| Нуклиды: | |
| стабильные | радионуклиды |
| (всего около 250) | (их более 3000) |
Уравнения радиоактивного распада записываются подобно уравнениям химических реакций. Например, атом трития распадается на ион гелия-3, электрон и особую частицу, которая называется электронное антинейтрино:
3 H → 3 He + + e — + ν e
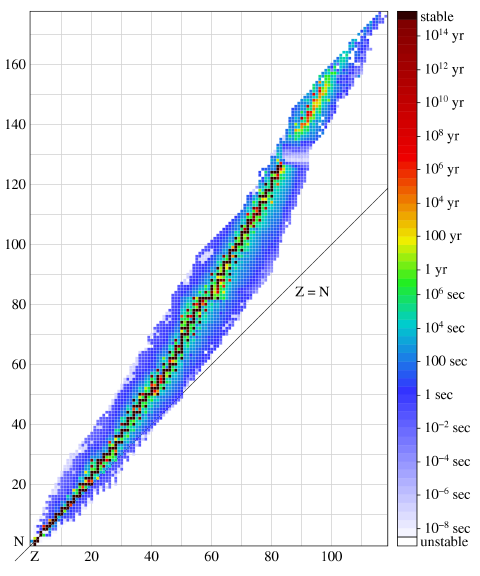
Большинство радионуклидов в природе не встречается и получено искусственно. Их устойчивость обычно характеризуется периодом полураспада t1/2 — интервалом времени, в течение которого вероятность распада ядра достигает 50%. Период полураспада может составлять от триллионных долей секунды до многих триллионов лет.
Интересно знать! Узкая цепочка наиболее стабильных нуклидов соответствует оптимальному соотношению нейтронов и протонов в ядре. Для заданного массового числа оно может быть выражено формулой
Для небольших значений массового числа A соотношение N/Z получается близким к единице, поэтому среди первых элементов распространены изотопы, у которых N = Z. Однако затем нейтронов становится больше, и, например, у стабильных изотопов свинца их число превышает число протонов примерно в полтора раза.
| Природный хлор | |
| 35 Cl | 37 Cl |
| m = 35 а.е.м. | m = 37 а.е.м. |
| 76% атомов Cl | 24% атомов Cl |
| mсредн. = 35·0,76 + 37·0,24 = 35,5 а.е.м. | |
Атомы разных изотопов имеют разные массы, но постоянство изотопного состава приводит к тому, что усреднённое значение массы атома данного элемента также постоянно. Именно это усреднённое по природным изотопам значение, выраженное в атомных единицах массы (а.е.м.), есть относительная атомная масса Ar данного элемента. В таблице Менделеева относительные атомные массы приведены для элементов, получаемых из природных источников.
Масса конкретного атома, выраженная в а.е.м., очень близка к его массовому числу A, так как масса одного нуклона примерно равна 1 а.е.м., а всего в атоме A нуклонов. Поэтому если в природе преобладает какой-то один изотоп данного элемента, то величина Ar этого элемента будет близка к массовому числу преобладающего изотопа. Именно поэтому относительные атомные массы многих элементов близки к целым числам. Однако не следует путать величины A и Ar : число A характеризует конкретный нуклид и указывает, сколько нуклонов в его ядре, а число Ar характеризует совокупность природных изотопов химического элемента и указывает усреднённое значение массы атома данного элемента в а.е.м.
Интересно знать! Точность величины Ar зависит от постоянства изотопного состава элемента. Натрий в природе представлен одним изотопом, поэтому никакой разбежки быть не может и Ar(Na) = 22,98976928 (все восемь знаков после запятой верны). Олово же представлено десятью изотопами; содержание каждого из них может варьироваться, поэтому Ar(Sn) = 118,710. Изотопы свинца постоянно образуются при радиоактивном распаде тяжёлых элементов, поэтому Ar(Pb) = 207,2. Для искусственно получаемых элементов величина Ar не имеет смысла, и в таких случаях вместо неё указывают в квадратных скобках массовое число самого долгоживущего из известных изотопов.
Нуклид
Слово « нуклид» было придумано Трумэном П. Кохманом в 1947 году. [2] [3] Кохман определил нуклид как «разновидность атома, характеризующаяся строением его ядра», содержащая определенное количество нейтронов и протонов. Таким образом, термин первоначально был сосредоточен на ядре.
Хотя слова нуклид и изотоп часто используются как синонимы, быть изотопами на самом деле является лишь одной связью между нуклидами. В следующей таблице перечислены некоторые другие отношения.
Нуклид и продукт его альфа-распада являются изодиаферами. [4]
но с разными энергетическими состояниями
См. Раздел « Обозначение изотопов» для объяснения обозначений, используемых для различных типов нуклидов или изотопов.
Самым долгоживущим ядерным изомером в неосновном состоянии является нуклид тантал-180m ( 180м 73Та ), период полураспада которого превышает 1000 триллионов лет. Этот нуклид существует изначально и никогда не наблюдался распада до основного состояния. (Напротив, нуклид тантал-180 в основном состоянии не встречается изначально, поскольку он распадается с периодом полураспада всего 8 часов до 180 Hf (86%) или 180 Вт (14%)).
Пример нуклидов, образованных в результате ядерных реакций, космогенных. 14
C
( радиоуглерод ), который образуется при бомбардировке космическими лучами других элементов, и нуклеогенный 239
Пу
который до сих пор создается нейтронной бомбардировкой естественного 238
U
в результате естественного деления урановых руд. Космогенные нуклиды могут быть стабильными или радиоактивными. Если они стабильны, их существование должно быть выведено на фоне стабильных нуклидов, поскольку каждый известный стабильный нуклид присутствует на Земле изначально.
Помимо 339 естественных нуклидов, более 3000 радионуклидов с различным периодом полураспада были искусственно произведены и охарактеризованы.
Четные и нечетные числа нуклонов
Нуклид
Нукли́д (лат. nucleus — «ядро» и др.-греч. είδος — «вид, сорт») — вид атомов, характеризующийся определённым массовым числом, атомным номером и энергетическим состоянием ядер и имеющий время жизни, достаточное для наблюдения. [1]
Содержание
Общее описание
Из определения следует, что нуклид — это каждый отдельный вид атомов какого-либо химического элемента с ядром, состоящим из строго определённого числа протонов ( Z ) и нейтронов ( N ), и которое находится в определённом энергетическом состоянии (основном состоянии или одном из изомерных состояний).
Число протонов Z представляет собой атомный номер элемента, а сумма A = Z + N — массовое число. Нуклиды, имеющие одинаковый атомный номер (обладающие одинаковым числом протонов), называются изотопами, одинаковое массовое число — изобарами, одинаковое число нейтронов — изотонами. Применение термина изотоп в единственном числе вместо термина нуклид хотя и, строго говоря, неверно, однако широко распространено. Относительная атомная масса нуклида округлённо равна его массовому числу, только для углерода-12 она по определению точно равна 12.
Классификация
Нуклиды делятся на стабильные и радиоактивные (радионуклиды, радиоактивные изотопы). Стабильные нуклиды не испытывают спонтанных радиоактивных превращений из основного состояния ядра. Радионуклиды путём радиоактивных превращений переходят в другие нуклиды. В зависимости от типа распада, образуются либо другой нуклид того же самого элемента (при нейтронном или двухнейтронном распаде), либо нуклид другого элемента (распады, изменяющие заряд ядра без вылета нуклонов, т. е. бета-распад, электронный захват, позитронный распад, все виды двойного бета-распада), либо два или несколько новых нуклидов (альфа-распад, протонный распад, кластерный распад, спонтанное деление).
Среди радионуклидов выделяются короткоживущие и долгоживущие. Радионуклиды, существующие на Земле с момента её формирования, часто называют природными долгоживущими, или примордиальными радионуклидами; такие нуклиды имеют период полураспада, превышающий 5·10 8 лет. Для каждого элемента были искусственно получены радионуклиды; для элементов с атомным номером (т. е. числом протонов), близким к одному из «магических чисел», количество известных нуклидов может доходить до нескольких десятков. Наибольшим количеством известных нуклидов — по 34 — обладают платина и осмий (без учёта изомерных состояний). Некоторые элементы имеют лишь один стабильный нуклид (так называемые моноизотопные элементы, например, золото и кобальт), а максимальным числом стабильных нуклидов — 10 — обладает олово. У многих элементов все нуклиды радиоактивны (все элементы, имеющие атомный номер больше, чем у свинца, а также технеций и прометий). Каждому массовому числу соответствует от 0 до 3 стабильных нуклидов, числу нейтронов — от 0 до 7. Общее число всех известных нуклидов превышает 3100 (без учёта изомеров; на сегодня известно около 1000 нуклидов в основных состояниях, для которых существуют одно или несколько метастабильных возбуждённых состояний с периодом полураспада, превышающим 0,1 мкс).
История и этимология
Слово нуклид был придуман Трумэн П. Кохман в 1947 г. [2] [3] Кохман определил нуклид как «разновидность атома, характеризующаяся строением ядра», содержащая определенное количество нейтронов и протонов. Таким образом, термин первоначально был сосредоточен на ядре.
Содержание
Нуклиды против изотопов
Типы нуклидов
Хотя слова «нуклид» и «изотоп» часто используются как синонимы, быть изотопами на самом деле является лишь одной связью между нуклидами. В следующей таблице перечислены некоторые другие отношения.
Нуклид и его альфа-распад продукт изодиафер. [4]
но с разными энергетическими состояниями
Увидеть Изотоп # Обозначение для объяснения обозначений, используемых для различных типов нуклидов или изотопов.
В природе существует 252 нуклида, распад которых никогда не наблюдался. Они встречаются среди 80 различных элементов, которые имеют один или несколько стабильных изотопов. Увидеть стабильный нуклид и первичный нуклид. Нестабильные нуклиды радиоактивный и называются радионуклиды. Их продукты распада («дочерние» продукты) называются радиогенные нуклиды. 252 стабильных и около 87 нестабильных (радиоактивных) нуклидов существуют в природе на Земле, в общей сложности около 339 природных нуклидов на Земле. [6]
Происхождение естественных радионуклидов
Природные радионуклиды можно условно разделить на три типа. [7] Во-первых, те, чьи период полураспада т1/2 составляют не менее 2% до возраста Земля (для практических целей их трудно обнаружить с периодом полураспада менее 10% от возраста Земли) ( 4.6 × 10 9 лет ). Это остатки нуклеосинтез это происходило в звездах до образования Солнечная система. Например, изотоп 238
U
(т1/2 = 4.5 × 10 9 лет ) из уран все еще довольно распространен в природе, но короткоживущий изотоп 235
U
(т1/2 = 0.7 × 10 9 лет ) встречается в 138 раз реже. Было обнаружено около 34 из этих нуклидов (см. Список нуклидов и Первородный нуклид подробнее).
Вторая группа радионуклидов, которые существуют в природе, состоит из радиогенные нуклиды такие как 226
Ра
(т1/2 = 1602 года ), изотоп радий, которые образованы радиоактивный распад. Они встречаются в цепочках распада первичных изотопов урана или тория. Некоторые из этих нуклидов очень недолговечны, например изотопы франция. Существует около 51 из этих дочерних нуклидов, период полураспада которых слишком короткий, чтобы быть первичными, и которые существуют в природе исключительно за счет распада более долгоживущих радиоактивных первичных нуклидов.
Пример нуклидов, образованных в результате ядерных реакций, космогенных 14
C
(радиоуглерод), который сделан космический луч бомбардировка другими элементами и нуклеогенными 239
Пу
который до сих пор создается нейтронной бомбардировкой естественного 238
U
в результате естественного деления урановых руд. Космогенные нуклиды могут быть стабильными или радиоактивными. Если они стабильны, их существование должно быть выведено на фоне стабильных нуклидов, поскольку каждый известный стабильный нуклид присутствует на Земле изначально.
Искусственно произведенные нуклиды
Помимо 339 природных нуклидов, более 3000 радионуклидов с различным периодом полураспада были искусственно произведены и охарактеризованы.
Известные нуклиды показаны в Таблица нуклидов. Список первичных нуклидов дается отсортированный по элементам, по адресу Список элементов по стабильности изотопов. Список нуклидов сортируется по периоду полураспада для 905 нуклидов с периодом полураспада более одного часа.
Сводная таблица количества нуклидов каждого класса
Это сводная таблица [8] для нуклидов 905 с периодом полураспада более одного часа, приведенных в список нуклидов. Обратите внимание, что числа неточные и могут немного измениться в будущем, если некоторые «стабильные» нуклиды будут радиоактивными с очень большим периодом полураспада.