Чего боится раковая опухоль
Чего боится раковая опухоль
После сердечно-сосудистых заболеваний рак является второй по значимости причиной смерти в большинстве стран. По прогнозам, новые случаи рака в 2030 году обойдутся мировому здравоохранению в 458 миллиардов долларов США (Всемирный экономический форум 2011 года).
Более половины всех случаев рака и смерти от онкологических заболеваний во всем мире считаются предотвратимыми. С самого начала приоритетным направлением по борьбе с заболеваниями являлась их профилактика, то есть проведение эффективных медицинских мероприятий, которые могут привести к резкому снижению смертности и инвалидности при относительно скромных затратах. Это междисциплинарный подход, соответствующие рекомендации были основаны на фактических данных, масштабируемыми и адаптируемыми в различных условиях. Мы знаем, что питание является одним из важнейших составляющих здоровья.
Продукты питания и пищевые компоненты, помимо базового питания, обеспечения нашего организма необходимыми пищевыми веществами, могут приносить пользу нашему здоровью, поддерживая его и, тем самым, снижая риск заболеваний.
Есть несколько исследований, показывающих связь между питанием и раком. Например, цистеин из чеснока или ликопин из томатов, при комбинированном употреблении, подавляют развитие химически индуцированного рака желудка. Аналогичным образом, витамин D 3 с генистеином при одновременном употреблении ускоряют ингибирование роста клеток рака предстательной железы. При этом концентрация в комбинации этих веществ более низкая, чем когда они давались парой.
В мире проводится не так много исследований о влиянии пищевых продуктов на здоровье, различные заболевания или связанных с ними состояний.
Мы знаем, что в процессе нормального функционирования организма образуются активные формы кислорода, в том числе супероксид, перекись водорода и гидроксильный радикал. Кроме того, синглетный кислород может образовываться в результате фотохимических реакций (например, в коже и глазах), а перекисное окисление липидов может вызывать образование пероксильных радикалов. Эти окислители приводят к старению нашего организма, а также к развитию дегенеративных заболеваний, таких как
рак и атеросклероз. Не только окисление является причиной рака; скорее всего не менее, а, возможно, и более важным фактором для канцерогенеза является воспаление. Воспаление вызывает рак по нескольким механизмам, включая выработку свободных радикалов воспалительными клетками.
Онкологические заболевания являются одной из основных проблем со здоровьем и причиной 1/8 смертей во всем мире.
Лечение онкологических заболеваний обычно включает в себя дорогостоящее и, нередко, травмирующее использование лекарств, хирургических вмешательств и радиационной терапии.
Питание и пищевые продукты связывают примерно с 30% всех случаев рака. Существуют многочисленные исследования, показывающие связь между питанием и снижением риска развития онкологических заболеваний.
Во всем мире люди используют питание, лекарственные травы и их экстракты или компоненты для предотвращения или лечения рака. Известно, что ряд пищевых продуктов имеют дополнительную пользу для нашего здоровья. Пища снабжает организм необходимым количеством витаминов, жиров, белков, углеводов и других питательных веществ, нужных нам для нормальной жизнедеятельности. Ряд соединений, естественным образом встречающихся в пищевых продуктах, в частности, антиоксиданты, показали себя как потенциальные профилактические вещества. Вероятно, антиоксиданты способны уменьшить повреждение свободными радикалами ДНК, что считается основной причиной большинства раковых заболеваний. Предполагается, что антиоксиданты могут снижать мутагенез и, следовательно, канцерогенез, как за счет уменьшения окислительного повреждения ДНК, так и за счет уменьшения клеточно-стимулированного деления клеток.
Фитохимические вещества делятся на различные группы, такие как каротиноиды, каротиноидные пигменты, ксантин, ликопин, астаксантин и другие фитохимические вещества.
Астаксантин является альфа-гидроксил-кетокаротиноидом. Он принадлежит к группе насыщенных кислородом каротиноидов или ксантофиллов, таких как лютеин и зеаксантин. Астаксантин уникален в том смысле, что он не только удаляет свободные радикалы, но и защищает от окисления и ограничивает выработку свободных радикалов. Астаксантин также повышает функцию других антиоксидантов, таких как витамины Е и С.
Астаксантин защищает наш организм от воздействия ультрафиолетового излучения. Также астаксантин может преодолевать гематоэнцефалический барьер и, таким образом, защищать ЦНС от свободных радикалов. Существуют исследования, подтверждающие противовоспалительную активность астаксантина и противораковую эффективность астаксантина, хотя механизм такого действия пока неизвестен. Астаксантин ингибируют развитие раковых клеток в печени, молочной железе, желудке.
Известно, что УФ-излучение является основным возбудителем в патогенезе опухолей кожи. Астаксантин и экстракты водорослей, обогащенные астаксантином, обеспечивают значительную защиту от УФ- излучения.
Лютеин и зеаксантин относятся к семейству ксантофиллов. Особенно высокая концентрация лютеина в зеленых листовых овощах, многих фруктах и цветных растениях, таких как сладкий перец, сладкая кукуруза, горох и яичный желток, киви, виноград, шпинат, апельсиновый сок, кабачки и различные виды тыквы. Кукуруза содержит наиболее количество лютеина (60%). Лютеин особенно активно проявляет свои антиоксидантные свойства в хрусталике глаза. Существуют исследования, подтверждающие, что лютеин более эффективен в подавлении перекисного окисления липидов, и сам лучше защищен от вторичного окислительного распада в присутствии мелатонина, глутатиона, альфа-токоферола и аскорбата.
Лютеин значительно уменьшает риск ишемической болезни сердца (ИБС) и риск инсульта. Потребление лютеина и зеаксантина обеспечивает защиту от отеков и гиперплазии кожи, вызванной воздействием УФ-излучения. Лютеин и зеаксантин снижают риск рака молочной железы, особенно в период пременопаузы. Есть исследования, указывающие на защитное воздействие лютеина от рака толстой кишки и от рака легких (но не у пожилых людей).
β-криптоксантин является углеводородным каротиноидом. β-криптоксантин
Кантаксантин является углеводородным каротиноидом. Кантаксантин впервые был выделен из съедобного гриба Cantharellus cinnabarinus. Кроме того, он обнаружен в нескольких зеленых и сине-зеленых водорослях. Он в ракообразных и различных видах рыб, включая карпа, кефаль. Кантаксантин обычно не считается диетическим каротиноидом, но он может быть включен в рацион человека благодаря его широкому применению в качестве красителя в пищевом производстве. Кантаксантин может предотвращать неконтролируемую пролиферацию клеток толстой кишки, молочной железы и кожи. Кантаксантин также доказал свою эффективность в предотвращении канцерогенеза в полости рта.
Мифы и заблуждения о раке
Существует много мифов и заблуждений о причинах онкологических заболеваний, которые можно услышать от друзей, знакомых, в СМИ и социальных сетях, а иногда даже от медработников.
Рассмотрим самые распространенные из них.
Рак заразен
В последнее время СМИ активно опровергают этот миф. Но долгое время считалось, что рак — заразное заболевание, т.е. онкобольной может передать опухоль другому человеку.
Любой инфекционный процесс включает в себя три основных компонента:
В отношении рака ни один из этих пунктов не справедлив: возбудителя рака как такого не существует, поскольку заболевание имеет совершенно другие механизмы развития. Но все-таки различные инфекции и рак имеют некую взаимосвязь.
Некоторые вирусы повышают риск развития определенных злокачественных опухолей. Например, вирус папилломы человека, вирус Эйнштейн-Барра (разновидность вируса герпеса), вирус гепатита В и С, вирус герпеса восьмого типа, хеликобактер пилори.
Однако существуют вакцины — определенные лекарственные препараты, которые повышают сопротивляемость к этим вирусам. Например, уже научно доказана и обоснована эффективность вакцин против гепатита В и вируса папилломы человека.
Таким образом, рак — не инфекционное заболевание, он абсолютно не заразен.
Употребление сахара приводит к развитию рака
Сахар жизненно необходим клеткам — как опухолевым, так и здоровым. В организме человека здоровые клетки стараются как можно эффективнее использовать сахар для получения энергии. Из одного грамма глюкозы образуется 38 молекул.
но опухолевые клетки используют иной механизм, в результате которого образуется всего лишь две молекулы. То есть опухолевые клетки в сравнении со здоровыми получают в 19 раз меньше энергии из одного грамма глюкозы. Самая популярная теория гласит, объясняет этот факт генетическими изменениями в структуре опухоли.
Да, сахар необходим человеческому организму. Но его избыток может привести к ожирению. Избыточная масса тела повышает риск развития некоторых злокачественных опухолей.
Так, у людей с ожирением повышен риск возникновения
Таким образом, сам сахар не является причиной возникновения злокачественных опухолей, но он может повышать вероятность возникновения некоторых из них.
Частое использование мобильных телефонов влияет на развитие опухолей
Почему возник такой миф? Исследователи объясняют:
У исследователей возникла идея проверить экспериментальным путем, действительно ли возникновение опухолей головного мозга связано с использованием мобильных телефонов.
В исследовании INTERPHONE приняли участие более 5 тысяч человек с опухолями головного мозга. Специалисты собрали данные о частоте использования мобильных телефонов пациентами. Выяснилось, что причинно-следственной связи между возникновением опухоли головного мозга и использованием мобильного телефона нет.
Такие ведущие организации мира, как American Cancer Society, National Institute of Envinronmental Health Sciences, Food and Drug Administration (FDA), CDC (Depasrtment of health and human servises, USA) высказали свое мнение о том, что мобильные телефоны совершенно безопасны.
Таким образом, возникновение опухолей головного мозга не связано с использованием мобильных телефонов, гаджеты даже не увеличивают риск возникновения рака.
Рак — это смертный приговор
На исход лечения и скорость реабилитации онкологического больного влияют различные факторы.
Также существует такое понятие, как стадии рака. Стадия определяет лишь выживаемость, т.е. вероятность прожить определенный промежуток времени. Чем выше стадия, тем эта вероятность меньше.
Как правило, при лечении злокачественных опухолей онкологи пользуются таким показателем, как пятилетняя выживаемость.
По мировым данным средняя пятилетняя выживаемость по основным онкологическим заболеваниям (рак легкого, молочной железы, ободочной кишки, предстательной железы, кожи) составляет 60%. Это достаточно высокий показатель.
Выживаемость зависит от типа опухоли. Один из самых низких показателей выживаемости наблюдается при раке поджелудочной железы, а один из самых высоких при раке кожи (базальноклеточный).
Таким образом, рак далеко не всегда смертный приговором для человека. С развитием технологий большинство видов онкологических заболеваний излечимы.
Если в семье не было случаев рака, то и у меня его не будет
Около 95% злокачественных опухолей являются спорадическими, т.е. они не зависят от того, был ли у кровных родственников рак или нет.
Но существуют определенные факторы риска, которые повышают вероятность возникновения онкологических заболеваний. Прежде всего — это возраст. Возраст — это единственный фактор риска, на который мы не можем повлиять. Также к факторам риска относятся употребление алкоголя, курение, длительные хронические воспалительные заболевания и так называемые канцерогенные факторы.
Но все они лишь повышают вероятность возникновения — не более, т.е. наличие данных факторов не обязательно приведет к развитию опухоли у человека.
Но в 5% случаев существуют наследственные опухоли, наследственные раковые синдромы: синдром Коудена, синдром Линча, синдром Гарднера, синдром Ли-Фраумени, синдром множественной эндокринной неоплазии и некоторые другие.
Если у человека есть какой-либо из этих наследственных синдромов, то ему необходимо проходить скрининговые программы на несколько лет или даже несколько десятков лет раньше, чем другим.
Таким образом, только в 5% случаев рак можно наследовать, а в большинстве случаев наличие онкологических заболеваний никак не связанно с наследственностью.
Лечение рака хуже самого заболевания
Существует миф о том, что жизнь с онкологическим заболеванием для пациента физически переносится легче в сравнении с лечением опухоли.
Сегодня используется три основных метода лечения злокачественных опухолей: хирургический, химиотерапевтический и метод лучевой терапии. Как правило все три метода используются комплексно.
Существует множество нежелательных последствий лечения онкозаболеваний, среди которых облысение, слабость, тошнота, кардиотоксичность и многие другие.
Последствия лечения онкологических заболеваний влияют на качество жизни, но с наличием широкого спектра медикаментов они переносятся гораздо легче.
У врача-онколога существуют две глобальные цели: увеличить продолжительность жизни пациента и повысить качество его жизни. В этой ситуации бывает непросто соблюсти баланс.
Онкобольные хотят знать как можно больше о своем диагнозе, причинах, возможных последствиях и предлагаемых методах лечения, Чаще всего пациенты доверяют методу, рекомендованному врачом. Специалисты стараются минимизировать негативные последствия терапии.
Таким образом, лечение злокачественной опухоли в большинстве случае не хуже, чем жизнь с этим заболеванием.
Депрессия способствует возникновению рака
Существует заблуждение, что негативные эмоции и тяжелые депрессии могут привести к возникновению рака.
Было проведено исследование, в котором приняли участие люди с тяжелыми формами депрессии. В результате было доказано, что риск возникновения злокачественной опухоли у людей с депрессивными расстройствами точно такой же, как и у людей, не имеющих таких расстройств.
Таким образом, плохое настроение абсолютно никак не влияет на возникновение и развитие опухоли и даже не является фактором риска её развития.
ГМО приводит к развитию рака
ГМО (генетически модифицированный организм) — организм, генотип которого был изменен искусственно. ГМО человек выводит достаточно давно. Одним из основных методов получения ГМО является селекция.
На данный момент не существует никаких исследований о том, что употребление ГМО приводит к развитию онкологических заболеваний.
Таким образом, ГМО не приводят к развитию рака, наукой не доказано обратное.
У людей с темной кожей не бывает рака кожи
По статистике рак кожи чаще возникает у людей со светлой кожей.
Основная причина развития рака кожи – воздействие ультрафиолетовых лучей. Защиту от них обеспечивает меланин, которого у людей со светлой кожей меньше.
Исследование ученых подтвердило: рак кожи встречается у людей с темной кожей. Но выживаемость таких людей с темной кожей намного ниже, чем пациентов со светлой кожей. Это обусловлено сложностью выявления, частотой выявляемости, поскольку обнаружить новообразование на темной коже сложнее, чем на светлой.
Одним из ярких примеров является регги-музыкант Боб Марли, который погиб в возрасте тридцати шести лет от поздно диагностируемой акральной меланомы, меланомы, развивающейся на коже ногтевых отделов.
Таким образом, цвет кожи никак не влияет на возможность возникновения рака кожи, и люди с темной кожей также могут иметь такой диагноз.
Использование антиперспирантов приводит к раку молочной железы
Было проведено исследование, в котором приняло участие 813 женщин в возрасте от 20 до 74 лет, имеющих рак молочной железы.
По данным этого исследования, использование антиперспирантов абсолютно никак не связано с развитием рака молочной железы.
В дальнейшем было проведено еще несколько исследований, которые аналогично подтвердили отсутствие причинно-следственной связи между возникновением рака молочной железы и использованием антиперспирантов.
Таким образом, на данный момент нет доказательств связи использования антиперспирантов и возникновения рака молочной железы.
Грудные импланты приводят к развитию рака молочной железы
На самом деле женщина, у которой есть импланты, и у которой их нет одинаково подвержены риску возникновения рака молочной железы.
Но существует очень редкое заболевание — анапластическая крупноклеточная лимфома молочной железы. Это заболевание не ткани молочной железы, а лимфатических узлов. И именно на развитие этого заболевания влияет наличие грудных имплантов.
Базовый риск развития этого заболевания составляет три на 100 000 000 случаев, а риск развития при наличии имплантов уже 203 на 100 000 000 случаев, т. е. риск повышается в 67 раз. Однако абсолютный показатель встречаемости данного заболевания крайне мал.
Таким образом, грудные импланты не связаны с раком молочной железы, но повышают риск возникновения лимфомы молочной железы.
Как защитить себя от заблуждений?
Для того, чтобы не поддаваться распространенным заблуждения, необходимо развивать критическое мышление.
Критическая оценка любой поступающей к вам информации может снять многие противоречия и защитить от заблуждений и мифов в вопросах здоровья.
Для врачей хорошим советом будет использовать рекомендации и методы доказательной медицины, которая предлагает опираться только на научно доказанные и безопасные для здоровья пациента действия.
Существует определенный алгоритм принятия решений, которому врачи стараются следовать:
Также на любом этапе необходимо обращать внимание на использование достоверных источников информации.
Рекомендации по ресурсам с информацией
Международные интернет-источники:
Российские интернет-источники:
Авторская публикация:
КОТОВ МАКСИМ АНДРЕЕВИЧ
врач-онколог
Статья подготовлена на основе лекции специалиста
Соревнуясь с раком
Соревнуясь с раком
Победить не берусь, перехитрить попробую (М.И. Кутузов).
Авторы
Редактор
Статья на конкурс «био/мол/текст»: На поиски новых способов борьбы с раком и усовершенствование существующих человечество уже потратило миллиарды долларов, а проблема всё так и остается нерешенной. Бесконечные войны с раком зачастую оканчиваются нашим поражением. Можно ли придумать волшебную пилюлю от рака и с гордостью заявить: «Всё, теперь-то мы победили»? К сожалению, ответ на этот вопрос для нас весьма неутешительный. Несмотря на то, что ученые по всему миру придумывают всё новые способы борьбы с онкологическими заболеваниями, рак тоже способен учиться: онкологическая терапия постоянно сталкивается с возникновением мультилекарственной резистентности.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Раковое ралли
Рак — это собирательное название группы смертельных и крайне разнородных заболеваний [1]. Однако все раковые клетки обладают набором характерных биологических признаков [2], позволяющих нам применять общие стратегии противораковой терапии.
Одним из таких признаков является хроническая пролиферация (бесконтрольное деление) клеток. Нормальные клетки нуждаются в ростовых факторах, продуцируемых товарищами [3], в то время как раковые могут обеспечивать себя сигналом «роста» самостоятельно. Представим, что опухоль в организме — это автомобиль, несущийся по трассе. В таком случае у автомобиля постоянно работает педаль газа (рис. 1).
Рисунок 1. Ракомобиль. В сравнении со здоровыми клетками организма, раковые — гоночный автомобиль: мощный, скоростной и небезопасный.
С другой стороны, в регуляцию клеточного роста включаются ингибиторные сигналы. Раковые клетки научились такие сигналы игнорировать. То есть наш «ракомобиль» оказывается еще и со сломанными тормозами.
Согласитесь, такое авто на дороге просто опасно для окружающих. Обычно водитель может понять, что скорость превышена, взглянув на спидометр. У клетки роль спидометра выполняет белок р53 — ключевой сенсор повреждения ДНК, запускающий гибель раковой клетки апоптозом (одним из видов программируемой клеточной смерти). Однако многие виды рака сопряжены с потерей функции р53, в результате чего механизмы самоликвидации не запускаются.
Пробег «раковой машины» определяют теломеры (концевые участки хромосом), сокращающиеся с каждым клеточным делением. Около 90% раковых опухолей обладают белком, способным увеличивать длину теломер [4], [5]. Таким образом, «ракомобиль» всегда кажется новенькой моделью, хотя на самом деле этой старой кляче просто скрутили показания одометра.
Несущийся по шоссе автомобиль поглощает литры горючего. Так и раковым клеткам необходимы питательные вещества и кислород, поэтому опухоли стимулируют прорастание кровеносных сосудов вокруг себя — ангиогенез, что облегчает доставку «топлива» к опухолям [6].
Многие опухоли обладают инвазивностью и способностью метастазировать [7–9]. И хотя первый процесс происходит в тканях, где опухоль появилась, а второй заключается в построении колоний в других тканях, генетически и биохимически оба процесса очень похожи. Скажем, что наша машина вдруг превращается в летающую.
Клетки иммунной системы, как инспекторы на дороге, сражаются со свихнувшимися раковыми клетками — нарушителями ПДД — и восстанавливают нормальные функции организма. Однако с иммунной системой не всё так просто. Как коррумпированные полицейские, входящие в состав преступного синдиката, иммунная система иногда способствует росту опухоли [10].
Терапия и резистентность. Кто кого?
Очевидно, что физиологически здоровая клетка должна претерпеть множество изменений, прежде чем превратиться в раковую. С одной стороны, все эти характерные изменения делают нормальную клетку очень опасной раковой, а с другой — служат основными мишенями лекарственной терапии. Противоопухолевая терапия сродни стрельбе из лука: чем выше дальность (селективность и биодоступность) и точность (наименьшее количество побочных эффектов), тем больше очков мы выигрываем в борьбе с опухолью. Не зря одним из самых популярных терминов в области является «таргетная терапия» (от англ. target — «цель», «мишень»). Именно отсюда возникает такое разнообразие групп препаратов [11]. Основные мишени противоопухолевой терапии — ДНК (как основной регулятор всех внутриклеточных процессов) и белки, выполняющие специфические функции.
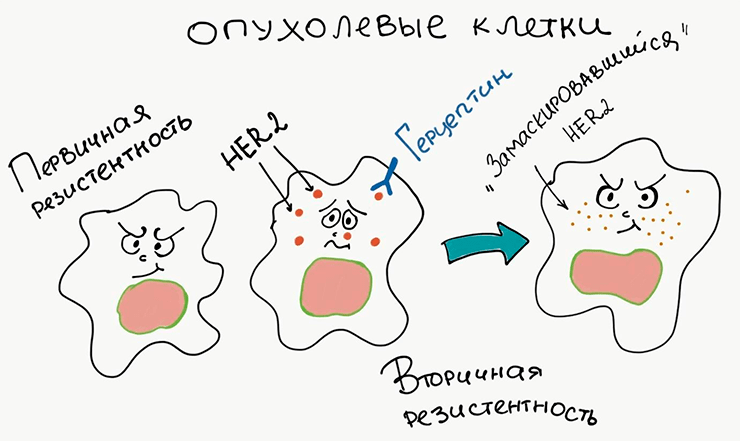
Многие из противоопухолевых препаратов весьма эффективны, однако к ним возникает устойчивость, в результате чего лечение ставится под угрозу. Резистентность может быть первичной (особенность конкретной опухоли) или вторичной (приобретенной, возникающей в ответ на прием препаратов). Попробуем разобраться на примере препарата «Герцептин».
«Герцептин» — высокоэффективный препарат, применяемый при раке груди [12], и механизм его действия связан с блокировкой рецептора HER2, помогающего опухолевым клеткам активно пролиферировать (выжимать педаль газа). Однако в случае, если у опухолевых клеток нет рецептора HER2, его блокировка «Герцептином», очевидно, совершенно бесполезна. Это значит, что опухоль обладает первичной резистентностью к этому препарату. Другое дело, когда в опухолевых клетках мутируют внутриклеточные каскады, связанные с рецептором HER2, и мишень теряется [13]. Так развивается вторичная резистентность (рис. 2).
Рисунок 2. Возникновение резистентности. Первичная резистентность к лекарству характерна для клеток, у которых изначально нет его мишени. Вторичная резистентность возникает в результате изменения мишени, при котором препарат теряет способность с ней связываться.
Самый очевидный способ обмануть опухоль и побороть резистентность — использовать как можно больше лекарственных препаратов, отличающихся по структуре и механизму действия. Однако, как ни парадоксально, опухоли способны спонтанно развивать резистентность к различным противоопухолевым агентам одновременно. Это и называется мультилекарственной резистентностью.
Интересно, что из всей пестрой популяции раковых клеток, совсем как в эволюционной теории Дарвина, выживают наиболее приспособленные. Часть клеток, вероятно, гибнет под действием лекарства, тогда как другая часть выживает и оказывается еще более неуловимой для терапии. Поэтому у онкологов есть препараты I, II и прочих линий. Как только одно лекарство перестает работать, нужно быстро назначить пациенту другое, а когда опухоль приспособится и к нему, дать третье, и так далее. К сожалению, список лекарств не бесконечен, именно поэтому вопрос изучения механизмов мультилекарственной резистентности очень важен.
Механизмы развития резистентности
Каким образом раковые клетки способны приобретать устойчивость? Как ученые могут эту устойчивость обойти? Борьбу с резистентностью можно сравнить с партией в шахматы. На каждый наш ход — новое противораковое лекарство — клетки опухоли придумывают маневр для ухода. Рассмотрим несколько таких ответных ходов: поговорим о мембранных переносчиках, особенностях метаболизма, мутации терапевтической мишени, клеточной гибели и о том, как раковые клетки придумали скрываться от «иммунных полицейских».
Ход 1. Шах от мембранных переносчиков
Как проникнуть внутрь клетки?
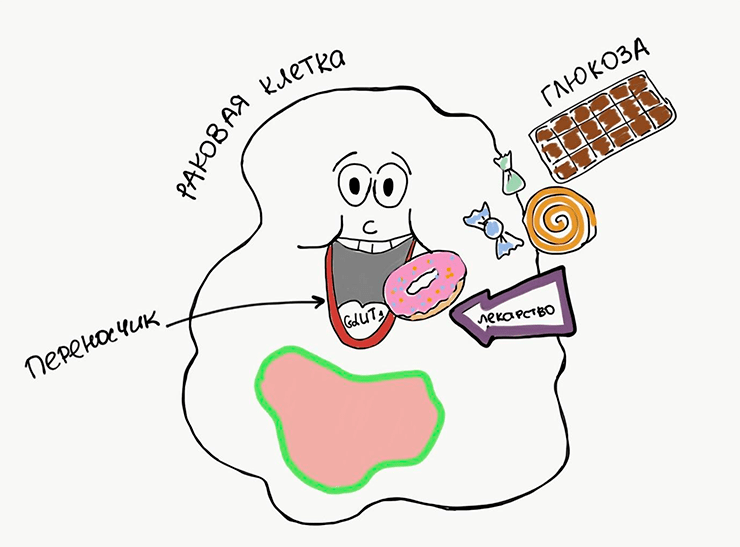
Все клетки нашего организма окружены мембраной — двойным слоем липидов, основная задача которого — поддерживать целостность и постоянство внутриклеточного содержимого [14]. Большинство молекул, необходимых для жизнедеятельности клетки, водорастворимы, а значит, через липидную мембрану они не проходят. Именно поэтому клеточная мембрана содержит сотни различных белков-переносчиков [15]. Вернемся к нашему примеру с «раковым автомобилем», нуждающимся в топливе: для закачки бензина необходим бензобак, им-то как раз и служат мембранные переносчики. Увеличение количества мембранных переносчиков, таких как селективный переносчик глюкозы GLUT1, отмечают в различных типах опухолей (рис. 3).
Глюкоза — лучшее «топливо» для клеток, а ее переносчик довольно хорошо изучен. Казалось бы, почему нельзя просто взять и заблокировать этот переносчик, ведь ни одна машина без бензина не поедет? Дело в том, что абсолютно идентичные переносчики работают и на мембранах здоровых клеток, которые нам еще пригодятся. Поэтому в терапии преобладает другой подход — ученые постоянно ищут способы, как можно использовать некоторые переносчики в своих целях. Например, доставить лекарство в клетку вместе с естественными для организма молекулами. Почему так сложно? Дело в том, что не всякое лекарство сможет проникнуть через липидную мембрану. Если это заряженная или водорастворимая молекула, то попасть в клетку она сможет только с помощью переносчика. К примеру, белок OCT1, находящийся в клеточной мембране лейкоцитов, переносит через нее противоопухолевый препарат иматиниб [16]. Этот переносчик не только повышает эффективность терапии хронического миелоидного лейкоза, но и позволяет врачам подбирать оптимальную эффективную дозу для пациентов [17].
Рисунок 3. Мембранные переносчики нужны для транспорта питательных веществ в клетку. Например, глюкоза поступает через переносчик GLUT1. Вместе с питательными веществами переносчики иногда могут транспортировать и молекулы лекарств.
Краеугольный камень мультилекарственной резистентности — это совсем другая группа мембранных транспортеров. В отличие от предыдущих переносчиков, они, наоборот, выкачивают из клетки всё ей ненужное. В первую очередь, конечно же, противоопухолевые препараты, которые мы с таким трудом в клетку доставили. Это семейство переносчиков со скромным названием «ABC» [18] в разы усложняет работу ученых и несет ответственность за возникновение резистентности к большей части лекарственных препаратов [19]. Главой семейства ABC-переносчиков можно назвать белок P-gp (P—гликопротеин, он же — MDR1, белок множественной лекарственной устойчивости 1) [20]. Каждый день он буквально спасает нас от смерти, выкачивая из клеток организма попавшие туда чужеродные и токсичные вещества.
Однако P-гликопротеин — двуликий Янус! Противоопухолевые препараты, которые назначают пациенту, он принимает за вражеских агентов и спешит поскорее избавить от них раковую клетку (рис. 4). Важно отметить, что все представители семейства ABC-транспортеров — переносчики неспецифические, которые переносят многие (главным образом, гидрофобные) молекулы, не различая их. Поэтому, увеличивая количество хотя бы одного белка-переносчика в мембране, раковая клетка автоматически приобретает навык выкачивать разные лекарства. Таким образом, рак сразу вычеркивает из нашего списка лекарств значительную их часть.
Рисунок 4. ABC-переносчики удаляют продукты жизнедеятельности и токсины из клетки. Такие переносчики (например, P-gp) неселективны, то есть удаляют из клетки всё подряд, в том числе лекарства.
Ход 2. Метаболический
Основная сложность противоопухолевой терапии состоит в том, что раковые клетки, пусть и немного свихнувшиеся, но всё же родственники здоровых клеток организма. А те в процессе эволюции разработали десятки защитных механизмов, спасающих их от чужеродных токсинов. Что в общем-то хорошо, ведь мы не хотим, чтобы лекарство блуждало по нашему организму целую вечность. Некоторые препараты обладают довольно высокой токсичностью, и их необходимо удалить как можно быстрее — ну, только после достижения эффекта. Однако раковые клетки научились менять метаболизм лекарства, что тоже приводит к резистентности.
Вместе с P-гликопротеином в команду резистентности попадает еще один белок — цитохром P450 (сокращенно его называют ЦИП. Не путать с цыплятами!). Этот белок — будем называть его для простоты P450 — является основным ферментом метаболизма лекарств. Если задуматься, это удивительно: как один белок может влиять на эффективность практически всех лекарств?
Попадая в организм, противоопухолевые препараты претерпевают изменения. Как мы помним, организм стремится поскорее избавиться от всего чужеродного, поэтому он меняет структуру противоопухолевого препарата так, чтобы тот не мог задерживаться в тканях и скорее выводился. Этой нелегкой работой как раз и занимается P450 (рис. 5a). И опять: как и все белки-защитники, P450 работает со всеми веществами подряд. Интересно, что цитохромы могут реагировать на сигнал от некоторых лекарств, активирующих или угнетающих их работу.
Рисунок 5а. Цитохром Р450 участвует в метаболизме лекарств: модифицирует их так, чтобы они легко выводились из организма.
Рисунок 5б. Р450 превращает пролекарства в активные лекарства.
Пытаясь использовать деятельность P450 на благо человечества, ученые разработали пролекарства — молекулы, которые P450 не лишает, а наделяет лекарственной активностью (рис. 5б). То есть в таблетке находится «спящая» молекула, а после «обработки» цитохромом она начинает работать: становится токсичной для опухоли. Однако в случае потери или снижения активности P450 такие противоопухолевые препараты остаются неактивными. Поэтому принимающим их пациентам советуют не пить грейпфрутовый сок — известный ингибитор P450 [21].
Казалось бы, вот они — пути борьбы с мультилекарственной резистентностью. Но стόит признаться, что тут рак поставил человечеству шах, от которого оно не может ускользнуть. Мы уже упоминали, что такие белки-защитники, как Р450 или P-gp, работают неселективно: помимо выкачивания противоопухолевых препаратов, Р-gp защищает наш мозг от попадания токсичных веществ, а цитохром Р450 окисляет эндогенные гормоны и метаболиты. Вмешиваясь в деятельность Р450 или P-gp, мы рискуем лишить организм естественной защиты и регуляции, что приводит к появлению токсинов.
Ход 3. Рокировка мишени
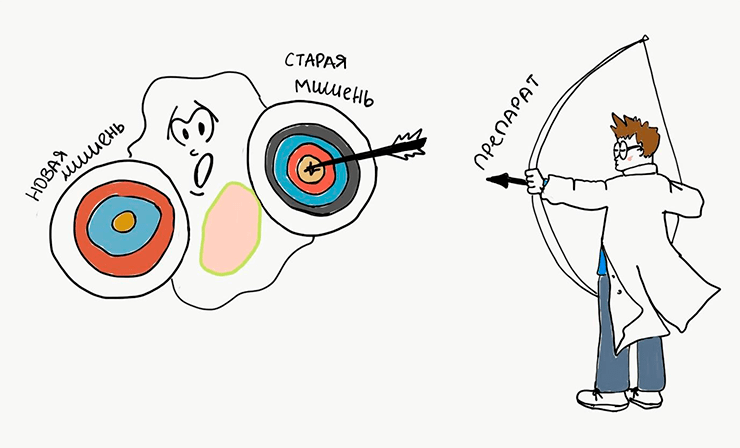
Помимо того, что наш организм и так усиленно пытается всеми возможными путями избавиться от противоопухолевых препаратов (ход 2), опухолевые клетки всегда начеку и в случае эффективности препарата стараются избавиться от его мишени (рис. 6). Как такое возможно? В условиях бесконтрольности раковые клетки накапливают мутации (изменения в ДНК), служащие резервным механизмом выживания клеток. Хитрость хода раковых клеток впечатляет: вместо того, чтобы пытаться всеми правдами и неправдами избавиться от лекарства, они в одну секунду делают препарат неактивным, избавляясь от его мишени. В случае с тем же «Герцептином», например, клетки просто теряют рецептор HER2, на который направлено действие препарата.
Рисунок 6. Как только опухолевая клетка изменит мишень лекарства, препарат сразу перестанет действовать. Тогда ученым нужно будет придумывать лекарство, бьющее по новой мишени.
Ход 4. Клеточный гамбит
Апоптоз (вид программируемой клеточной гибели) — это не только естественный механизм устранения опухолевых клеток, но и желаемый результат использования противоопухолевых препаратов. Апоптоз постоянно запускается в клетках, в которых что-то пошло не так — например, повреждена ДНК или не работают необходимые белки (рис. 7). Он проходит тихо, и клетка, умирая, оставляет после себя только безвредные ошмётки, легко удаляемые соседями. Должно быть, читателю уже стало понятно, что апоптоз — один из ключевых пунктов, против которого будет бороться раковая клетка. Здоровые физиологически клетки имеют много механизмов, запускающих апоптоз, и белков — регуляторов апоптоза, что позволяет клетке-герою надежно отличить опасную для всего организма ситуацию и пожертвовать собой, тихонечко скончавшись. Это умение, конечно, достается по наследству и раковым клеткам, однако они быстро учатся справляться с апоптозом.
Рисунок 7. Один из механизмов программируемой клеточной гибели — апоптоз — работает в многоклеточном организме постоянно. Отслужившие клетки тихонечко самоликвидируются, оставляя после себя лишь безвредные крохотные тельца.
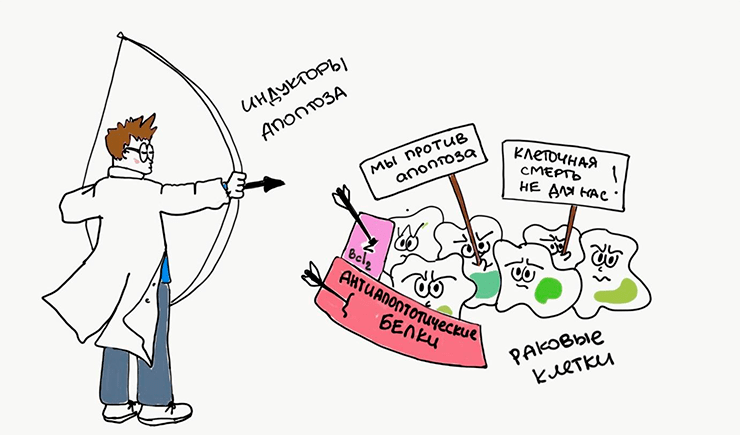
Апоптоз может инициироваться целым рядом противоопухолевых препаратов, повреждающих ДНК. Однако опухолевые клетки научились противостоять нашим атакам. Дефекты апоптотических каскадов дают им преимущество выживать даже тогда, когда в нормальных условиях клетки бы уже давно почили (рис. 8). Несмотря на то, что в этом противостоянии опухолевые клетки пока что одерживают победу, ученые не опускают руки. Разветвленность апоптотических путей позволяет нам разрабатывать всё новые препараты, облегчающие ход уже запущенного апоптоза [22]. Так действует, например, новая группа лекарственных средств — миметики проапототических белков [23].
Рисунок 8. Раковые клетки стремятся избежать апоптоза. Они усиливают работу антиапоптотических белков, а ученые, наоборот, пытаются апоптоз индуцировать.
Ход 5. Микропешки
Клетки никогда не находятся в одиночестве, они образуют «коммуну» — объединяются в ткани и активно взаимодействуют с клетками других тканей. Кроме того, клетки должны прочно закрепиться на одном месте, а не болтаться по организму. А вот раковые клетки иногда, как мы уже упоминали, игнорируют это правило и образуют метастазы, когда «теряют сцепление» с окружающей их средой. Также для опухоли очень важно иметь вокруг себя кровеносные сосуды, через которые она получает питательные вещества. Если опухоль большого размера, она может сдавливать кровеносные сосуды. Но не нужно радоваться слишком рано: такое сдавление усложняет доставку и противоопухолевых препаратов к центру опухоли. Ее периферические клетки лекарство победит, а вот находящиеся в самом сердце опухоли выживут, мутируют, и всё начнется сначала.
Помимо того, что одна популяция раковых клеток может стать резистентной к лекарству, она может обучить другую популяцию, спасая таким образом чувствительные к лекарству опухолевые клетки от смерти и сводя на нет все усилия врача. Информация о том, как сопротивляться лекарству, зашифрована в виде микро-нуклеиновых кислот. Обычно это регуляторные микроРНК, упакованные в очень маленькие пузырьки — микровезикулы (рис. 9). Всё это «мимимикро» — очень коварный ход со стороны рака. МикроРНК регулируют экспрессию генов устойчивости. А микровезикулы защищают «ценную» информацию от разрушителей РНК (РНКаз) [24]. Микровезикулы могут передаваться от одних клеток к другим, высвобождать микроРНК. Бороться с таким транспортом ученые пока не научились.
Рисунок 9. Микровезикулы переносят от одной раковой клетки к другой микроРНК, регулирующие экспрессию генов устойчивости. Таким образом гетерогенная группа клеток становится устойчивой к терапии.
Ход 6. Иммунный ферзь
Иммунная система — хранитель благополучия организма. И раковые клетки, разумеется, всеми возможными путями пытаются скрыться от грозных стражей, снующих по организму. «Раковая машина» скрывает свои настоящие водительские права — антигены (молекулы, способные вызвать иммунный ответ), которые позволяют «инспекторам» различать свои и чужеродные клетки.
Иммунная система в научной среде сейчас по-настоящему в тренде. И конечно, фармацевтические компании не могут обойти эту тему стороной. В онкотерапии истинный бум вызвали две новые группы препаратов — моноклональные антитела и перепрограммированные модифицированные Т-клетки (CAR T-клетки) [25]. Про модифицированные Т-клетки «Биомолекула» уже не раз писала [26], [27], как и про идею моноклональных антител [28], [29]. Мы же в очередной раз хотим обратить внимание на конкретную группу лекарств — чек-поинт ингибиторы [30], [31], за которые Джеймс Эллисон (James Allison) и Тасуку Хоньо (Tasuku Honjo) получили Нобелевскую премию по физиологии или медицине 1 октября этого года. [32] Подробнее об этом событии читайте в нашем специальном выпуске! [33]
Началось всё с открытия белка PD-L1 на поверхности раковой клетки, что, на самом деле, никого не впечатлило. Открыли какой-то там белок — молодцы! Ну и что? А вот когда обнаружили его рецептор PD-1 на поверхности Т-клеток, началось самое интересное. Расшифровываются эти аббревиатуры как programmed death ligand 1 и programmed cell death protein 1. То есть удалось обнаружить настоящих вестников смерти раковых клеток! PD-L1 есть и у здоровых клеток иммунной системы. В норме при взаимодействии этих молекул — рецептора и лиганда — посылается ингибиторный сигнал Т-клеткам, которые должны распознавать чужеродные фрагменты и уничтожать их. Получая ингибиторный сигнал, Т-клетки понимают, что эту конкретную клетку убивать не нужно. Эта проверка (чек-поинт) позволяет сохранять нормальные, здоровые клетки. Как уже, вероятно, догадался читатель, хитрые раковые клетки научились экспрессировать на своей поверхности PD-L1, вводя в заблуждение иммунных полицейских. Ингибиторы такого взаимодействия — новое слово в борьбе против рака (рис. 10).
Рисунок 10. Раковые клетки научились обманывать иммунный надзор: они показывают PD-L1, который обычно есть у нормальных иммунных клеток. PD-L1 (мячик) связывается с рецептором PD-1 на Т-клетках (щенок на страже), в этом случае иммунные клетки принимают раковые «за своих» и не атакуют. Препараты — ингибиторы PD1-PDL1-взаимодействия (косточка) позволяют иммунным клеткам обойти обманный маневр врагов.
Шах и мат?
Борьба с возникновением мультилекарственной резистентности сродни игре в шахматы. Каждый раз ученые придумывают новые способы терапии, к которым рано или поздно раковые клетки вырабатывают резистентность. Возможно, эта партия будет длиться до бесконечности, пока мы не узнаем чего-то принципиально нового о механизмах развития онкологических заболеваний [34]. Современная онкотерапия постоянно дополняется рекомендациями, часто авторитет и интуиция врача играют большую роль. К сожалению, у онкологов не всегда есть время для раздумий над следующим ходом. Но не унывай, читатель! Каждый раз, когда ученые открывают очередную маленькую молекулу на поверхности раковой клетки или придумывают, как обойти тот или иной механизм возникновения лекарственной резистентности, человечество делает еще один шаг к победе над раком.